Modalități de a explica diferitele culori ale flăcării. Colorare - flacără
Culoarea flăcării este violetă, bb descoperirea potasiului prin culoarea flăcării în prezența sodiului este indicată în capitolul despre acesta din urmă.
Colorarea flăcării - karma și roșu nou.
Nu dă colorație la flacără.
Colorarea flăcării se datorează saltului electronilor de pe orbitele mai îndepărtate de nucleul atomului corespunzător până la cele mai apropiate de acesta. Excitarea se realizează în acest caz datorită energiei termice a flăcării.
Colorarea în flacără galben indică prezența sodiului în substanță.
O flacără galbenă indică prezența sodiului în sarea A.
O flacără galbenă indică prezența sodiului în substanță.
De exemplu, din cauza căldurii flăcării, atomii de sodiu absorb 200 8 kJ/mol de căldură, în timp ce atomul este excitat și electronii se deplasează la niveluri de energie mai înalte.
Colorarea flăcării atunci când metalele alcaline sau compușii acestora sunt introduși în ea este cauzată de tranzițiile electronice ale atomilor excitați anterior. Odată cu tranziția inversă a electronilor, apare radiația, care este percepută sub forma unei culori a flăcării.
Vopsirea la flacără este folosită ca metodă de testare pentru detectarea bariului. Sărurile de bariu și soluțiile lor colorează flacăra culoare galben-verde.
Colorarea flăcării atunci când metalele alcaline sau compușii acestora sunt introduși în ea este cauzată de tranzițiile electronice ale atomilor excitați anterior. Odată cu tranziția inversă a electronilor, apare radiația, care este percepută sub forma unei culori a flăcării.
Colorarea la flacără cu săruri de calciu, stronțiu și bariu se realizează folosind sârmă de platină pură umezită cu soluții de săruri volatile ale acestor metale și introdusă în flacăra unei lămpi cu alcool, alternativ.
Colorarea la flacără cu săruri de stronțiu și bariu este folosită pentru a obține semnal, sau așa-numitele sclipici.
Colorarea flăcării deschiderea ionilor 58 înainte și înapoi 80 separarea ionilor 58 viteza 111 e.
Colorare cu flacără arzător de gaz compușii metalici sunt utilizați în analiza calitativă pentru a descoperi cationii metalici care emit radiații în regiunea vizibilă a spectrului.
Dacă colorarea flăcării nu detectează prezența sodiului, atunci separarea de magneziu nu este necesară. Pentru descoperirea magneziului și potasiului în prezența lor comună, o parte din soluție este testată pentru Mg cu ajutorul Na.
Pentru a colora flacăra, în compoziții se introduc compuși ai unor metale. La temperaturi ridicate dezvoltate în timpul arderii compușilor, compușii metalici se disociază parțial sau complet și, trecând în stare de vapori, dau un spectru de radiații. Fiecare metal îi conferă un spectru de culoare specială, caracteristică.
Colorarea flăcării se observă în Violet.
Reacțiile de colorare a flăcării nu fac posibilă efectuarea unor astfel de concluzii și este foarte important să le facem pentru a alege cele mai potrivite metode pentru analiza cantitativă a unei substanțe.
Reacțiile de colorare cu flacără și obținerea perlelor colorate se efectuează cu o cantitate mică de substanță, care este introdusă pe un fir de platină sau nicrom în flacăra unui arzător cu gaz sau a unei țevi de suflare. Reacțiile de descompunere sau sublimare a sării se efectuează în eprubete din sticlă refractară, în pahare sau creuzete din porțelan și metal.
Flacăra nu dă o reacție de colorare.
Reacția de culoare a flăcării nu dă.
Reacția de colorare la flacără este o reacție de deschidere la sodiu foarte sensibilă. Reacția de colorare a flăcării se realizează astfel: un mic cristal de sare de sodiu este introdus pe o buclă de platină în flacăra incoloră a arzătorului, care devine galbenă.
Reacțiile de colorare cu flacără și obținerea perlelor colorate se efectuează cu o cantitate mică de substanță, care este introdusă pe un fir de platină sau nicrom în flacăra unui arzător cu gaz sau a unei țevi de suflare.
Motivele colorării flăcării nu au fost încă clarificate. Totuși, acest fenomen nu este cauzat de arderea SnH4, despre care se credea anterior că se formează în timpul reducerii compușilor de staniu cu zinc metal.
Reacțiile de colorare a flăcării și de obținere a perlelor colorate se desfășoară cu o cantitate mică de substanță pe un fir de platină sau nicrom introdus în flacăra unui arzător cu gaz sau a pistolului.
Motivele colorării flăcării nu au fost încă clarificate. Totuși, acest fenomen nu este cauzat de arderea SnH4, despre care se credea anterior că se formează în timpul reducerii compușilor de staniu cu zinc metal.
Colorand flacara in culoare portocalie-rosu dacă compusul de calciu este volatil.
Prin culoarea galben intens a flăcării, care dispare când este privită prin sticlă de cobalt (albastru).
Ce explică colorarea flăcării cu introducerea sărurilor unui număr de metale.
Efectuând reacția de colorare a flăcării, pe o buclă de sârmă de platină (sau nicrom), substanța de testat este introdusă în flacăra incoloră a arzătorului.
Proba este testată pentru colorarea flăcării, deoarece unele dintre elementele care formează compuși volatili colorează flacăra în culoarea lor caracteristică, de exemplu, bariu - galben-verde, sodiu - galben.
Proba este testată pentru colorarea flăcării, deoarece unele dintre elementele care formează compuși volatili colorează flacăra în culoarea lor caracteristică, de exemplu, bariu - galben-verde, sodiu - galben.
În testele de colorare la flacără se poate întâmpla ca colorația provenită de la unul dintre elementele analizate, prezentă în cantități mari, să mascheze colorarea de la alte elemente.
Produși de descompunere și compoziție chimică substanta investigata. Pentru testarea vopsirii la flacără se recomandă să luați un fir de 60 mm lungime, cu diametrul de 0 3 mm. Un capăt al acestui fir este îndoit într-o buclă cu un diametru de 2 - 3 mm, celălalt capăt este lipit cu grijă într-o tijă de sticlă, care servește drept mâner. Sârma trebuie curățată bine prin coacere repetată în partea cea mai fierbinte a flăcării arzătorului neluminos. Calcinarea este alternată cu coborârea capătului firului în acid clorhidric concentrat.
Taliul este descoperit prin colorarea la flacără și metoda spectrală, precum și prin formarea de cristale caracteristice la acțiunea sărurilor de taliu monovalent, iodură de potasiu, cloroplatinat, cromat 13], tiosulfat, iodovismutit [5J, acid uric, acid picrolonic 17], prin apariția unei culori caracteristice la acțiunea benzidinei (sau o-toluidinei) asupra sărurilor trivalente de taliu.
Ce reacții de culoare la colorarea la flacără pot fi efectuate pentru grupul IV de elemente.
Manifestată extern sub formă de colorare a flăcării, emisia de raze luminoase de către atomii încălziți ai metalelor alcaline se datorează saltului electronilor de la niveluri de energie mai înalte la niveluri inferioare.
Flăcările vin în culori diferite. Privește în șemineu. Flăcări galbene, portocalii, roșii, albe și albastre dansează pe bușteni. Culoarea sa depinde de temperatura de ardere și de materialul combustibil. Pentru a vizualiza acest lucru, imaginați-vă spirala unei sobe electrice. Dacă țigla este oprită, spirele sunt reci și negre. Să presupunem că ai decis să încălziți supa și ați pornit plita. La început, spirala devine roșu închis. Cu cât temperatura crește mai mult, cu atât culoarea roșie a spiralei este mai strălucitoare. Când țigla se încălzește până la temperatura maxima, spirala devine portocaliu-rosu.
Desigur, spirala nu arde. Nu poți vedea flacăra. Ea este foarte fierbinte. Dacă îl încălzești mai mult, atunci și culoarea se va schimba. La început, culoarea spiralei va deveni galbenă, apoi albă, iar când va deveni și mai fierbinte, o strălucire albastră va emana din ea.
Ceea ce determină culoarea flăcării
Ceva similar se întâmplă cu flăcările. Luați o lumânare de exemplu. Diferite părți ale flăcării lumânării au temperaturi diferite. Focul are nevoie de oxigen. Dacă acoperi lumânarea Borcan de sticlă, focul se va stinge. Centrul flăcării lumânării, adiacent fitilului, consumă puțin oxigen și arată întunecat. Mai mult oxigen este livrat în partea superioară și pe părțile laterale ale flăcării, astfel încât aceste zone sunt mai luminoase.
Pe măsură ce flacăra se mișcă de-a lungul fitilului, ceara se topește și trosnește, rupându-se în particule minuscule de carbon. ( Cărbune constă și din carbon.) Aceste particule sunt transportate de flacără și ard. Sunt foarte fierbinți și strălucesc ca spirala plăcii tale. Dar particulele de carbon sunt mult mai fierbinți decât spiralele celei mai fierbinți plăci (temperatura de ardere a carbonului este de aproximativ 1.400 de grade Celsius). Prin urmare, strălucirea lor este galbenă. Lângă fitilul care arde, flacăra este încă mai fierbinte și strălucește albastru.
Flacăra unui șemineu sau a unui foc de tabără are în mare parte un aspect variat. Lemnul arde la o temperatură mai scăzută decât fitilul lumânării, așa că culoarea principală a focului este portocaliu, nu galben. Unele dintre particulele de carbon din foc sunt destul de fierbinți. Nu sunt multe, dar adaugă o tentă gălbuie la flacără. Particulele răcite de carbon incandescent sunt funingine care se depune cosuri de fum... Temperatura de ardere a lemnului este mai mică decât temperatura de ardere a lumânării. Calciu, sodiu și cupru, încălzite la o temperatură ridicată, strălucesc în diferite culori. Ele sunt adăugate la praful de pușcă al rachetelor pentru a colora luminile artificiilor de sărbători.
Culoarea flăcării și compoziția chimică
Culoarea flăcării se poate schimba în funcție de impuritățile chimice conținute în bușteni sau alte materiale combustibile. Flacăra poate conține, de exemplu, impurități de sodiu. Sodiul este componentă sare de masă. Dacă sodiul este încălzit, acesta devine galben strălucitor. Calciul poate intra în foc.
Știm cu toții că laptele conține mult calciu. Este metal. Calciul fierbinte devine roșu aprins. Dacă fosforul arde în foc, flacăra va deveni verzuie. Toate aceste elemente fie sunt conținute în lemn, fie merg la foc cu alte substanțe. Amestecarea culorilor unei flăcări, ca și amestecarea culorilor curcubeului, poate da culoare alba prin urmare, zonele albe sunt vizibile în flăcările unui foc sau șemineu.
Evaluare cu stele GD
un sistem de rating WordPress
Întrebarea numărul 1
NOȚIUNI DE BAZĂ
Chimia analitică este o ramură a științei chimice care dezvoltă, pe baza legilor fundamentale ale chimiei și fizicii, metode și tehnici fundamentale de analiză calitativă și cantitativă. Analiza chimică este înțeleasă ca un ansamblu de acțiuni care au ca scop obținerea de informații despre compoziția chimică a unui obiect. În funcție de sarcină, se determină compoziția elementară, moleculară, de fază, izotopică, materială etc. În funcție de tipul de particule identificate, acestea se disting: analize elementare, moleculare, funcționale, izotopice și de fază.
Analiza elementară este o analiză chimică calitativă și (cel mai adesea) cantitativă, în urma căreia se determină ce elemente chimice și în ce rapoarte cantitative sunt incluse în analit.
^ Analiză funcțională- descoperirea și determinarea diferitelor grupări funcționale, de exemplu, gruparea amino NH 2, gruparea nitro NO 2, carbonil C = O, carboxil COOH, hidroxil OH, nitril CN etc.
^ Analiza moleculară- descoperirea şi definirea moleculară compozitia moleculara analit, adică elucidarea ce molecule și în ce rapoarte cantitative constă un anumit obiect analizat.
^ Analiza de fază- descoperirea si determinarea diverselor faze (solide, lichide, gazoase) incluse in sistemul analizat
In functie de masa de substanta uscata sau de volumul solutiei de analit, metodele de analiza se impart in: macro-, semi-micro-, micro-, ultramicro- si submicrometode de identificare.
^
Caracteristicile metodelor de analiză în funcție de dimensiunea eșantionului
Pentru identificarea chimică, reacțiile de formare a compușilor colorați, eliberarea sau dizolvarea precipitatelor, gazelor, formarea de cristale de formă caracteristică, colorarea flăcării unui arzător cu gaz, formarea compușilor luminescenți în soluții sunt cel mai adesea folosit.
^
Colorarea la flacără cu compuși ai unor elemente
Colorarea flăcării unui arzător cu gaz cu compuși metalici este utilizată în analiza calitativă pentru a descoperi cationi metalici care emit radiații în regiunea vizibilă a spectrului.
Se spune că chimia analitică este știința metode și mijloace analiza chimică și, într-o anumită măsură, stabilirea structurii chimice. Prin mijloace, dispozitive, reactivi, probe standard, programe pentru calculatoare etc.
Metode și fonduri sunt în continuă schimbare: sunt implicate noi abordări, sunt folosite noi principii ale fenomenului din diferite domenii ale cunoașterii. Chimia analitică este un domeniu de cercetare științifică, astfel încât pentru crearea multor metode de analiză au fost premiate premii Nobel(microanaliza organică, polarografie, tipuri diferite analiză cromatografică, spectroscopie fotoelectronică etc.). Ar trebui făcută o distincție între metodă și metoda de analiză.
Metoda de analiză a substanțelor - aceasta este scurtă definiție principiile care stau la baza analizei substanțelor
Metoda de analiză - aceasta este descriere detaliata toate condițiile și operațiunile care asigură corectitudinea, reproductibilitatea și alte caracteristici specificate ale rezultatelor analizei.
Corectitudinea analizei caracterizează calitatea analizei, reflectând apropierea de zero a erorii sistematice a rezultatelor.
Reproductibilitatea analizei - arată gradul de apropiere între ele a rezultatelor măsurătorilor (determinărilor) individuale la analiza probelor.
În general, sub analiză implică obținerea de date empirice privind compoziția chimică și cantitatea unei substanțe prin orice metodă - fizice, chimice și fizico-chimice .
Chimia analitică modernă include trei secțiuni: analiză chimică calitativă, analiză chimică cantitativă și instrumentală, i.e. fizice și fizice metode chimice. Alocarea metodelor instrumentale într-o secțiune independentă este într-o oarecare măsură arbitrară, deoarece cu ajutorul acestor metode sunt rezolvate sarcinile analizei calitative și cantitative.
Analiza chimică calitativă - Aceasta este definiția (descoperirea) elementelor chimice, ionilor, atomilor, grupărilor atomice, moleculelor din substanța analizată.
Analiza chimică cantitativă Este definiția compoziției cantitative, adică stabilirea numărului de elemente chimice, ioni, atomi, grupări atomice, molecule din analit.
La efectuarea analizelor calitative și cantitative se folosesc semne analitice ale substanțelor și reacții analitice.
Caracteristici analitice - acestea sunt proprietățile analitului sau ale produselor transformării acestuia, care fac posibilă aprecierea prezenței anumitor componente în acesta.
Caracteristici analitice tipice - culoare, miros, unghi de rotație al planului de polarizare a luminii, radioactivitate, capacitatea de a interacționa cu radiatie electromagnetica si etc. Răspuns analitic Este un produs chimic. transformarea unui analit sub acțiunea unui reactiv analitic cu formarea de produse cu caracteristici analitice vizibile.
Reacțiile cele mai des folosite sunt:
Formarea compușilor colorați
Izolarea sau dizolvarea precipitatelor
Evolutia gazelor
Formarea cristalelor de formă caracteristică
Colorarea flăcării unui arzător cu gaz
Formarea compușilor luminescenți în soluții
Rezultatele reacțiilor analitice sunt influențate de temperatură, concentrația soluțiilor, pH-ul mediului, prezența altor substanțe (procese de interferență, mascare, catalizare)
Exemplu:
1.
Ionul de cupru Cu 2+ în soluții apoase există sub formă de aquocomplexuri [Cu (H 2 O) m], la interacțiunea cu amoniacul capătă un complex solubil de culoare albastru-albastru strălucitor:
[Cu (H2O)m] + 4NH3 = 2+ + n H2O
2.
Ionul Ba 2+ poate fi precipitat prin adăugarea unei soluții care conține ioni de sulfat sub forma unui precipitat alb ușor solubil de sulfat de Ba:
Ва 2+ + SO 4 2- → ВаSO 4 ↓
Precipitatul alb de carbonat de Ca 2+ se dizolvă sub acțiunea acizilor, în timp ce se eliberează dioxid de carbon:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
3.
Dacă se adaugă alcali la o soluție de sare de amoniu, atunci se eliberează amoniac gazos. Poate fi identificat cu ușurință prin miros sau decolorarea albastră a hârtiei de turnesol roșu umed:
NH4 + + OH- = NH3 . H2O → NH3 + H2O
Sulfurile sub acțiunea acizilor emit hidrogen sulfurat gazos:
S2- + 2H+ = H2S
4.
Ioni Na + într-o picătură de soluție la interacțiunea cu ioni hexahidroxoantimonat (V).
Formează cristale albe de hexahidroxantimonat de sodiu (V) Na de o formă caracteristică:
Nа + + - = Nа
Forma cristalului este clar vizibilă atunci când este privită la microscop.
Această reacție este folosită pentru a deschide cationul Na +
5.
Vopsirea flăcării unui arzător cu gaz cu compuși metalici este utilizată pentru a deschide cationi metalici, emitând radiații în regiunea vizibilă a spectrului. Colorarea flăcării într-o culoare sau alta depinde de natura metalului.
6.
Uneori se efectuează reacții analitice, ale căror produse au proprietățile luminiscenței în soluții. Deci, atunci când cationul interacționează cu acetatul de zinc uranil, se observă o strălucire verde a soluției, iar cu acetatul de uranil de sodiu într-un mediu de acid acetic, dă o luminiscență galben-verde.
Întrebarea numărul 2
Aplicarea metodelor potențiometrice și coulometrice de analiză în farmacie și chimie analitică. Metoda potențiometrică este o metodă de analiză calitativă și cantitativă bazată pe măsurarea potențialului apărut între soluția de testat și un electrod scufundat. Această metodă este recomandată pentru asigurarea calității și analiza cantitativă a unor preparate farmaceutice. Folosind titrarea potențiometrică, este posibil să se stabilească punctul de echivalență mai obiectiv, prin urmare metoda își găsește o aplicație practică largă. Una dintre direcțiile metodei potențiometrice este cronopotențiometria. Esența acestei metode constă în faptul că potențialul unuia dintre electrozi este înregistrat în funcție de timp. Pe lângă scopurile analitice, metoda poate fi utilizată pentru studiul proceselor cinetico-chimice. Metoda potențiometrică poate fi folosită și pentru studiul proceselor de distrugere a substanțelor medicinale în timpul depozitării. Metoda coulometrică este foarte promițătoare pentru analiza medicamentelor: unele anestezice locale, sulfonamide, alcaloizi. Metoda coulometrică se bazează pe legea lui Faraday, care stabilește o relație între cantitatea de substanță eliberată pe electrozi și cantitatea de energie electrică consumată pentru acest proces. Analiza farmaceutica - determinarea calitatii medicamentelor si medicamente fabricat de industrie si farmacii. Analiza farmaceutică cuprinde: analiza medicamentelor, a materiilor prime medicinale, controlul producției de medicamente, analiza toxicologică în obiecte de origine vegetală și animală, analiza chimică criminalistică. Pentru controlul calității medicamentelor se folosesc metode de analiză farmacopee - metode descrise în monografiile farmacopee aprobate la nivel de stat sau incluse în Farmacopeea de stat - o colecție de standarde și reglementări naționale care reglementează calitatea medicamentelor. Analiza farmacopee este controlul calității materiilor prime medicinale, substanțelor, formelor de dozare, efectuat în conformitate cu cerințele Farmacopeei sau monografiilor farmacopeei individuale neincluse în Farmacopee.
Întrebarea numărul 3
O caracteristică analitică este o modificare observată vizual, înregistrată instrumental, a proprietăților substanțelor care intră în reacții analitice. Caracteristicile analitice includ următoarele. 1. Formarea (sau dizolvarea) unui precipitat cu anumite proprietăți: culoare, solubilitate în anumiți solvenți, formă cristalină. Aceasta poate fi formarea unui precipitat de formă cristalină tipică, o culoare sau aspect caracteristic (de exemplu, un precipitat alb de AgCl). Când se separă, de exemplu, fosfatul de zinc de fosfatul de aluminiu, este investigată capacitatea precipitatului de fosfat de zinc de a se dizolva într-o soluție apoasă de amoniac cu formarea de CC. 2. Obținerea unui compus solubil colorat sub acțiunea unui reactiv, de exemplu Cu (OH) 2 + 4NH3 = Cu (NH3) 42 - cupru albastru amoniac. 3. Eliberarea de gaz cu proprietăți cunoscute. Când CaCO3 și CaSO4 sunt dizolvate în acid clorhidric, în ambele cazuri se eliberează gaz care, atunci când este trecut prin apă de baritic, formează precipitate identice în exterior de carbonat de bariu și, respectiv, de sulfit. În consecință, CO2 și SO2 nu pot fi distinse cu apa baritică. Dacă treceți fiecare dintre gaze printr-o soluție diluată de permanganat de potasiu acidulat cu acid sulfuric, atunci CO2 nu va provoca nicio modificare a culorii soluției, iar SO2 cu permanganat de potasiu va reacționa ca agent reducător: 2KMnO4 + 5S02 + 2H20 = 2MnS04 + K2S04 + 2H2S04, ceea ce va duce la dispariția culorii purpurie a soluției de permanganat de potasiu. Reacțiile analitice calitative sunt folosite pentru a descoperi sau detecta ioni sau molecule ale unei substanțe. O reacție chimică însoțită de o caracteristică analitică (sau semnal analitic) prin care se poate aprecia prezența unui analit se numește reacție analitică. Răspunsul analitic ar trebui să aibă o limită de detecție scăzută. Limita de detecție este cea mai mică cantitate dintr-o substanță care poate fi determinată printr-o reacție dată cu o probabilitate dată P. Reacțiile analitice calitative se realizează prin adăugarea altor substanțe numite reactivi la soluția de analit. Reacțiile analitice pot avea loc între lichid, solid și substante gazoase... Reacțiile chimice analitice sunt clasificate în reacții generale, de grup, selective și specifice. Reacțiile generale sunt reacții ale căror semnale analitice sunt aceleași pentru mulți ioni. Reactivul folosit este denumit și generic. Reacțiile de grup sunt un caz special de reacții comune utilizate în conditii specifice pentru a izola un anumit grup de ioni cu proprietăți similare. Reacțiile generale și de grup sunt utilizate pentru izolarea și separarea ionilor dintr-un amestec complex. Selectiv, sau selectiv, se referă la reacții care permit detectarea unui număr limitat de cationi sau anioni într-un amestec de ioni. Deci, atunci când NH.SCN acționează asupra unui amestec de cationi, doar doi cationi formează compuși complexi colorați solubili: 3_ și (Co (SCN),] 2-. Reacțiile analitice se numesc specifice, al căror efect analitic este caracteristic doar pentru unul. ion în prezența altor ioni, iar reacțiile specifice în analiza calitativă se numesc reacții caracteristice calitative (sau particulare)
Răspunsul analitic trebuie să îndeplinească anumite cerințe. Nu ar trebui să fie prea lent și suficient de ușor de finalizat. Specificitatea și sensibilitatea sunt cerințe critice pentru reacțiile analitice. Cu cât reacţionează mai puţini ioni cu un anumit reactiv, cu atât această reacţie este mai specifică. Cu cât cantitatea de substanță poate fi determinată mai mică folosind un reactiv dat, cu atât această reacție este mai sensibilă. Sensibilitatea reacției poate fi cuantificată folosind doi indicatori: minimul de deschidere și diluția limită. Cantitatea minimă care trebuie deschisă este cea mai mică cantitate dintr-o substanță sau ion care poate fi deschisă de un anumit reactiv în condiții date. Diluția limitativă caracterizează cea mai mică concentrație a unei substanțe (sau ion) la care este încă posibilă deschiderea acesteia cu acest reactiv.
Întrebarea numărul 4
Pregătirea probei pentru analiză. Dacă măsurătorile cantitative sunt efectuate în soluție, proba este dizolvată într-un solvent adecvat; concentrația probei este selectată astfel încât să se încadreze în intervalul de aplicabilitate al metodei. Uneori este necesară izolarea unui analit dintr-un amestec, deoarece multe metode de analiză sunt nespecifice și chiar neselective. O metodă specifică se numește o metodă prin care se determină doar o anumită substanță, iar selectivă este o metodă preferabilă pentru o anumită substanță, folosindu-se de care pot fi determinate alte substanțe. Există foarte puține metode specifice și altele mult mai selective. De exemplu, spectrometria de masă și imunotestul sunt foarte selective.
„Dizolvarea probei”) sau transformarea probei într-o substanță solubilă, de exemplu, prin fuziune cu sodă, potasiu, sulfat acid de sodiu, alcali etc.
Dacă nu se găsește un solvent, atunci precipitatul analizat este transformat prin încălzire sau fuziune cu unul sau altul reactiv în produși de reacție solubili și acești produși sunt dizolvați în apă sau acizi.
Când proba analizată conține sulfați de plumb și cationi din a treia grupă analitică, care sunt insolubili în acizi, aceștia pot fi transformați în carbonați solubili în acid prin fierbere cu o soluție apoasă saturată de sodă Na2CO3 și potasiu K2CO3 sau prin fuziune cu un amestec. de Na2CO3 și K2CO3.
b) Fuzionați cu un amestec de sifon și potasiu.
Când se topesc, sulfații sunt transformați în carbonați, ca la fierbere (vezi.
Fuziunea solidelor cu reactivii.
Cu o astfel de fuziune, componentele probei solide analizate, insolubile în apă și în acizi, sunt transformate în produși de reacție care se dizolvă în acizi.
Deci, de exemplu, dioxidul de siliciu și silicații insolubili atunci când sunt topiți (de preferință într-un creuzet de platină) cu un amestec de sodă și potasiu sunt transformați în silicați de sodiu sau potasiu solubili și carbonați corespunzători:
pot fi transformate în produși de reacție solubili prin fuziune cu KHSO4 sau K2S2O7 (în creuzete de cuarț cu capac), de exemplu:
Unii oxizi de metal sunt transformați în săruri solubile și atunci când sunt fuzionați cu sifon, de exemplu:
În multe alte cazuri, sunt descrise metode și tehnici pentru transformarea probelor insolubile în produși de reacție solubili prin fuzionarea fazelor solide cu diverși reactivi.
Dacă o probă solidă nu se dizolvă în niciunul dintre solvenții utilizați, atunci într-un număr de cazuri este transformată într-o stare solubilă prin tratare cu încălzire (de obicei repetă) cu soluții saturate de sodă Na2CO3, potasiu K2CO3 sau prin topirea unei părți. a probei cu aceste săruri, hidrosulfați de metale alcaline (NaHZOD pirosulfat de potasiu K2S207, cu alcalii și alte substanțe.
Întrebarea numărul 5
În literatură, nu există date exacte cu privire la momentul nașterii chimiei toxicologice (legale) ca știință în Rusia. Există doar informații conform cărora prima cercetare chimică de natură chimică criminalistică a fost efectuată în Rusia în secolul al XV-lea. Pe atunci, încă nu existau laboratoare chimice care să studieze diferite obiecte pentru prezența otrăvurilor. Cercetarea chimică criminalistică a fost aleatorie și a fost efectuată în farmacii.
La sfârşitul secolului al XVI-lea - începutul secolului al XVII-lea. în Rusia, a fost înființat Apothecary Prikaz (datele cu privire la data exactă a înființării Apothecary Prikaz sunt contradictorii), care este cea mai înaltă instituție administrativă medicală a Rusiei pre-Petrine. Ordinul Farmaceutic era responsabil de afacerile medicale și farmaceutice din Rusia. Era responsabil de laboratorul în care medicamentele, băuturi, vodcă, etc. În același laborator și în farmacii, s-au efectuat ocazional studii medico-chimice individuale. Cu toate acestea, în perioada Aptekarsky Prikaz, examinările medico-legale și chimice criminalistice nu au fost legalizate.
Primul document care a legalizat examinarea medico-legală în Rusia a fost Carta militară emisă de Petru I până în 1716. După cum subliniază M. D. Shvaikova, examinarea medico-legală în Rusia a fost probabil legalizată împreună cu examinarea medico-legală. Cu toate acestea, nici după publicarea Regulamentului Militar, autopsiile nu au fost efectuate peste tot. Cadavrele au fost deschise în spitalele din Moscova și Sankt Petersburg, iar apoi au început treptat să facă autopsii în alte orașe ale Rusiei.
În 1797, în multe provincii, au fost înființate consilii medicale, care supravegheau întregul activitati medicale, inclusiv cele care prevăd efectuarea de cercetări medicale criminalistice. În cadrul acestor consilii s-a stabilit funcția de farmacist de personal, care trebuia să efectueze cercetări chimice și depistarea otrăvurilor. Nu existau laboratoare la consiliile medicale. Prin urmare, farmaciștii interni au efectuat studiul otrăvurilor în laboratoare sau farmacii private.
Crearea primului laborator chimic rusesc de către M.V.Lomonosov în 1748 a fost eveniment importantîn dezvoltarea științei ruse. Laboratorul a asigurat influență mare privind dezvoltarea chimiei în general, inclusiv dezvoltarea chimiei analitice, ale cărei metode au fost utilizate pe scară largă în analizele chimice criminalistice.
În ciuda unor succese în domeniul chimiei criminalistice, înainte începutul XIX Artă. s-a dezvoltat încet. Nivelul științific și teoretic al metodelor utilizate în practica expertului a fost scăzut. Nu existau chimiști legal calificați în acel moment. Chimia criminalistica nu a fost predata la universitati sau alte institutii de invatamant. Datorită nivelului scăzut de dezvoltare a chimiei analitice, nu existau metode pentru detectarea multor otrăvuri. Nu existau manuale sau manuale de chimie legală.
XIX Art. caracterizată printr-o îmbunătăţire semnificativă a stării cercetării chimice criminalistice. În 1808, un departament farmaceutic a fost deschis la Facultatea de Medicină a Universității din Moscova. Materia „farmacie” a fost inclusă în programa de studii a acestei secții. În studiul acestui subiect s-a acordat o atenție deosebită toxicologiei și detectării otrăvurilor. Același departament a fost deschis la Sankt Petersburg la Academia Medico-Chirurgicală. Ceva mai târziu, în alte universități s-au deschis departamente de farmacie.
Odată cu dezvoltarea educației farmaceutice în Rusia, a crescut un cadru de oameni de știință, ale căror lucrări au îmbogățit chimia criminalistică cu noi metode de analiză. Erau manuale și manuale de chimie legală.
Unul dintre primii oameni de știință ruși care a îmbogățit chimia criminalistică cu noi reacții și metode de analiză a fost A.P. Nelyubin (1785-1858), care a fost medic și farmacist prin educație. A condus Departamentul de Farmacie din cadrul Academiei Medico-Chirurgicale. A făcut spectacol A.P. Nelyubin un numar mare de teste pentru prezența otrăvurilor. El a fost primul care a propus o metodă de distrugere a materialului biologic care conține „otrăvuri metalice” cu acid azotic. El a propus o metodă pentru detectarea compușilor de arsenic prin transformarea acestora în hidrogen arsenos. AP Nelyubin și-a rezumat bogata experiență în domeniul analizei chimice criminalistice în lucrarea sa „Reguli pentru conducerea unui medic criminalist în studiul otrăvirii”, publicată în 1824 în Military Medical Journal. În această lucrare, omul de știință a acordat o mare atenție studiului otrăvurilor.
A.P. Nelyubin a fost autorul manualului „Chimie criminalistică și polițienească generală și privată cu adaos de toxicologie generală sau știința otrăvurilor și antidoturilor”. La acea vreme, chimia polițienească era înțeleasă ca analiză sanitar-chimică (analiza Produse alimentare).
Un om de știință proeminent în domeniul chimiei criminalistice a fost prof. A. A. Iovskiy (1796-1857). La Universitatea din Moscova, a ținut prelegeri despre chimie generală și analitică, farmacologie și toxicologie. A. A. Iovskiy a fost autorul a aproximativ 40 de lucrări dedicate diferitelor ramuri ale farmaciei. În 1834, cartea sa „A Guide to Recognizing Posons, Antidotes and definiție esențială primul, atât în corp cât și în afara lui prin chimicale numiti reactivi”.
O mare contribuție la dezvoltarea farmaciei și chimiei criminalistice a avut-o prof. Yu. K. Trapp (1814-1908), care a fost elev al lui A.P. Nelyubin. În timp ce lucra la Academia Medico-Chirurgicală, Yu. K. Trapp a analizat diverse obiecte pentru prezența otrăvurilor, a studiat semnături false, pete de cerneală, bancnote carbonizate etc.
Yu. K. Trapp a fost autorul unor cărți de chimie criminalistică. În 1863, publică cartea sa „Ghid pentru primele manuale în caz de otrăvire și pentru studiul chimic al otrăvurilor”, iar în 1877 – cartea „Manual de cercetare chimică criminalistică”.
O anumită contribuție la dezvoltarea chimiei criminalistice a avut-o profesorul Universității Dorpat (azi Tartu) G. Dragendorf (1836-1898). El a propus un reactiv pentru detectarea alcaloizilor, a dezvoltat o metodă de izolare a alcaloizilor din materialul biologic, bazată pe izolarea acestor substanțe cu apă acidulată cu acid sulfuric. G. Dragendorf a publicat manualul „Descoperirea chimică legală a otrăvurilor” și a fost primul om de știință care a izolat chimia criminalistică din farmacie și a citit-o ca disciplină independentă.
O serie de lucrări în domeniul chimiei criminalistice au fost efectuate de G.V. Struve (1822-1908), care a fost un specialist de profil larg. Munca sa este dedicată dezvoltării chimiei criminalistice, analitice și biologice. GV Struve a propus o reacție pentru detectarea compușilor de arsen și fosfor cu molibdat, metode îmbunătățite pentru detectarea cianurilor, morfinei, stricninei și a altor alcaloizi. A efectuat o serie de examinări complexe în domeniul detectării otrăvurilor în materialul biologic. O parte din munca sa este dedicată studiului contrafacerii alimentelor etc.
În secolul al XIX-lea. o serie de studii importante în domeniul chimiei criminalistice au fost efectuate de oameni de știință care au lucrat în alte domenii ale chimiei. Acestea includ: T. E. Lovitz, Η. Η. Zinin, D. I. Mendeleev și alții T. E. Lovits (1757-1804) au efectuat o serie de examinări pentru a stabili cauzele otrăvirii. N.N.Zinin (1812-1880) a efectuat examinări, al căror scop era stabilirea calității proaste a vinurilor, pentru determinarea prezenței petelor.
Pe unele subiecte, determinarea impurităților din ceaiul chinezesc etc. El a efectuat o serie de examinări pentru a stabili cauzele otrăvirii.
DI Mendeleev (1834-1907) a efectuat o serie de examinări la instrucțiunile autorităților judiciare și de investigație. Timp de mulți ani la departamentul medical al Ministerului Afacerilor Interne, a fost membru al consiliului medical, care la acea vreme era cea mai înaltă instanță de expertiză judiciară din Rusia.
Un rol important în cercetarea în domeniul chimiei criminalistice îi revine prof. SP Dvornichenko, care a rezumat datele propriilor cercetări și datele din literatură în domeniul analizei chimice criminalistice și a publicat în 1900 un ghid de chimie criminalistică.
Prof. A.P. Dianil (1851 -1918) a jucat un rol important în dezvoltarea chimiei criminalistice autohtone. Timp de peste treizeci de ani a lucrat la Academia de Medicină și Științe Chirurgicale. În acest timp, A.P.Dianin a efectuat aproximativ 5000 de analize. A combinat munca la academie cu munca în Departamentul medical al Ministerului Afacerilor Interne. În 1904 A.P.Dianin a fost numit expert șef în chimie legală.
Super Octombrie revoluție socialistă a făcut schimbări fundamentale în toate domeniile vieții sociale și în dezvoltarea științei în țara noastră. S-a schimbat organizarea expertizei criminalistice și chimice judiciare. Examenul medico-legal a devenit un asistent de încredere al autorităților judiciare sovietice în consolidarea legalității socialiste.
În 1918, la Comisariatul de Sănătate al Poporului RSFSR a fost înființată un departament de examinare medicală. Au fost create departamente similare sub autorităţile provinciale de sănătate. După un timp, au fost introduse posturile de experti criminalistici provinciali și orășenești și au fost organizate și laboratoare de criminalistică provinciale.
În 1924, la Moscova a fost creat un laborator criminalistic central, care a fost transformat în 1932 în Institutul de Cercetare de Stat de Medicină Legală. Pentru a îndruma expertiza medico-legală și chimică criminalistică din țara noastră în anul 1937, în subordinea Comisariatului Poporului pentru Sănătate al URSS, a fost introdusă funcția de expert principal în medicină legală.
În 1934, Comisariatul Poporului pentru Sănătate al RSFSR, de comun acord cu Parchetul RSFSR, a aprobat „Regulile pentru examinarea medico-legală și criminalistică a probelor materiale”. În 1939 Consiliul Comisarii Poporului URSS a adoptat o rezoluție „Cu privire la măsurile de consolidare și dezvoltare a expertizei medicale criminalistice”. În 1952, Ministerul Sănătății al URSS, dar în acord cu Parchetul URSS, Ministerul Justiției și Ministerul Securității Statului URSS, a aprobat „Instrucțiunea privind efectuarea examenului medico-legal în URSS”.
În 1957, Ministerul Sănătății al URSS, în acord cu Procuratura URSS și Ministerul Afacerilor Interne al URSS, a aprobat noi reguli pentru examinarea chimică criminalistică a probelor materiale în departamentele de chimie legală ale laboratoarelor de medicină legală.
În 1962, ministrul sănătății al URSS a emis un ordin „Cu privire la măsurile de îmbunătățire a examinării medico-legale în URSS”. În 1978, Ministerul Sănătății al URSS a aprobat o nouă instrucțiune privind efectuarea unui examen medico-legal, un regulament privind biroul de examinare medicală legală și a acestuia. oficiali... Recent, pe lângă documentele enumerate mai sus, au fost aprobate o serie de prevederi care vizează îmbunătățirea calității expertizei criminalistice și chimice criminalistice în URSS.
Un rol important în dezvoltarea ulterioară a chimiei criminalistice revine unui număr de oameni de știință autohtoni și instituții de învățământ superior din domeniul farmaceutic.
În 1920, la Facultatea de Chimie-Farmaceutică a Universității a II-a din Moscova și la Institutul Chimico-Farmaceutic din Petrograd au fost create primele departamente de chimie criminalistică, care au devenit centrul cercetare științificăîn analize chimice criminalistice și un centru de formare pentru chimiști experți. Ceva mai târziu, în alte institute au fost create departamente de chimie legală.
De câțiva ani, Departamentul de Chimie Legală a Institutului Chimico-Farmaceutic Leningrad a fost condus de prof. L.F.Ilyin (1872-1937). Este autorul unui număr de lucrări de chimie legală. Mai multe teze au fost finalizate sub supravegherea sa.
În dezvoltarea chimiei criminalistice, un anumit rol îi revine prof. N.I.Border (1866-1941), care a predat la Institutul Farmaceutic Perm, și prof. N.A. Valyashko (1871 - 1955). Timp de 15 ani, N.A. Valyashko a fost consultant al departamentului de chimie al Institutului de Cercetare Științifică din Harkov al Ministerului Justiției. În acest timp, a publicat o serie de lucrări de analiză chimică criminalistică. Sub îndrumarea prof. N.A. Valyashko și-a finalizat și susținut dizertația de candidat T.V. Marchenko, care ani lungi Ea a fost șefa Departamentului de Chimie Legală de la Institutul Farmaceutic Harkov.
Prof. A. V. Stepanov (1872-1946) a creat și a condus Departamentul de Chimie Legală la Institutul Farmaceutic din Moscova. A fost unul dintre organizatorii acestui institut.
științific și activitate pedagogică A. V. Stepanova aparține chimiei criminalistice și organice. El a dezvoltat o metodă pentru determinarea compușilor organici clorurati, care este încă utilizată pe scară largă în analiza substanțelor organice halogenate. A. V. Stepanov a propus o metodă de mineralizare
Materialul biologic este un amestec de azotat de amoniu și acid sulfuric. Împreună cu M.D.Shvaikova, a dezvoltat o metodă de mare viteză pentru izolarea alcaloizilor din alimentele de origine vegetală. A publicat lucrări de analiză chimică criminalistică, a publicat un manual de chimie legală, organică și analitică. Manualul său „Chimie legală” a fost publicat de patru ori.
Din 1937 până în 1978, Departamentul de Chimie Legală de la Institutul Farmaceutic din Moscova (atunci la facultatea Primului Institut Medical din Moscova) a fost condus de profesorul M.D.Shvaikova (1905-1978), student al prof. A. V. Stepanova.
Zona de cercetare științifică a M.D.Shvaikova este grozavă. Împreună cu prof. A. V. Stepanov, ea a propus o metodă de mare viteză pentru izolarea alcaloizilor din alimentele de origine vegetală. MD Shvaikova este fondatorul aplicării metodei microcristaloscopiei în analiza chimică criminalistică, sub conducerea ei s-au efectuat cercetări și în domeniul analizei chimice criminalistice a „otrăvurilor metalice”, alcaloizilor, barbituricelor și a multor alți compuși toxici. Aceasta este o mare contribuție la analiza chimică criminalistică.
Un rol important în dezvoltarea medicinei legale și a chimiei legale revine Institutului de Cercetare Științifică de Medicină Legală al Ministerului Sănătății al URSS, care a fost organizat în 1932. Institutul conduce activitatea de cercetare în domeniul medicinei legale și al chimiei legale și efectuează de asemenea examinări complexe și repetate la instrucțiunile organelor criminalistice - de anchetă.
Angajații secției de chimie a acestui institut au elaborat o metodă de determinare cantitativă a mercurului în materialul biologic, a fost elaborată și pusă în practică o metodă de izolare a alcaloizilor din materialul biologic, bazată pe izolarea acestora cu apă acidificată cu acid oxalic. . metoda fracționată cercetare chimică criminalistică „a „otrăvurilor metalice”, au fost dezvoltate metode de analiză chimică criminalistică a unui număr de glicozide, se efectuează cercetări pentru analiza pesticidelor și a altor substanțe toxice, derivați de fenotiazină.
Angajații departamentului de chimie al Institutului de Cercetare de Medicină Legală au publicat o serie de scrisori metodologice și îndrumări privind studiul substanțelor toxice din materialul cadaveric. Tehnicile descrise în aceste scrisori sunt utilizate pe scară largă în laboratoarele de chimie criminalistică ale URSS.
O anumită contribuție la dezvoltarea chimiei toxicologice a avut-o departamentele Institutului Medical din Lviv, institutele farmaceutice Tașkent și Pyatigorsk, precum și alte instituții de învățământ.
În 1939, Departamentul de Chimie Legală (Toxicologică) a fost organizat la Facultatea de Farmaceutică a Institutului Medical din Lviv. Din 1948 catedra a fost condusa de prof. V.F.Krama-Renko. Direcția științifică a departamentului este dezvoltarea metodelor de analiză chimică și toxicologică a alcaloizilor, analogilor lor sintetici și barbituricelor. V.F.Kramarenko este
cu aproximativ 200 lucrări științifice privind utilizarea metodelor chimice, fizice și fizico-chimice de analiză (fotocolorimetrie, spectrofotometrie, cromatografia în straturi subțiri de adsorbanți, cromatografia pe gel, cromatografia gaz-lichid etc.) în chimia toxicologică. El a propus o metodă pentru izolarea alcaloizilor din materialul biologic, bazată pe izolarea acestora cu apă acidulată cu acid sulfuric.
.Un rol important în dezvoltarea chimiei toxicologice în țara noastră revine departamentului de chimie (șeful departamentului A. F. Rubtsov) al Institutului de Cercetare de Stat de Medicină Legală al Ministerului Sănătății al URSS. Acest institut a dezvoltat o serie de tehnici noi pentru studiul substanțelor toxice. Au fost publicate linii directoare pentru studiul mai multor otrăvuri în obiectele supuse analizelor chimice și toxicologice.
În anii postbelici s-au înregistrat progrese în pregătirea personalului științific în chimia toxicologică (legală). Deci, la Institutul Farmaceutic din Moscova, iar apoi la Facultatea de Farmacie a Primului Institut Medical din Moscova sub îndrumarea prof. M.D.Shvaikova a finalizat și a susținut șase doctorate și patruzeci teze de doctorat... La aceeași secție sub îndrumarea conf. univ. BN Izotov a finalizat și susținut 12 dizertații de candidați.
La Institutul Medical din Lviv sub îndrumarea prof. V.F.Kramarenko a pregătit și susținut cinci lucrări de doctorat și 31 de teze de candidați. La aceeasi catedra sub indrumarea prof. V. I. Popova a susţinut patru teze de doctorat. Nouă teze de doctorat au fost susținute sub îndrumarea conf. univ. A. F. Rubtsov. Același număr de teze au fost susținute la Institutul Farmaceutic Tașkent sub îndrumarea prof. L. T. Ikramova.
La Departamentul de Chimie Toxicologică a Institutului Farmaceutic Tașkent au fost efectuate o serie de studii, dedicate în principal analizei pesticidelor.
Cercetările în analiza substanțelor toxice se desfășoară la departamentele de chimie toxicologică, institute farmaceutice și alte institute.
Rezultatele analizei toxicologice chimice depind de alegerea corecta obiectele de cercetare, respectarea regulilor de analiză chimică și toxicologică a materialului biologic pentru prezența substanțelor toxice, alegerea corectă a metodelor de cercetare și alți factori.
Analiza calitativă a cationilor
Na +
Reacție de colorare la flacără
Înmuiați un fir curat fierbinte într-o soluție de clorură de sodiu sau puneți puțină sare tare pe el. Injectați firul împreună cu picături sau particule de sare de sodiu în flacăra incoloră a arzătorului - flacăra devine galbenă.
K +
Reacție de colorare la flacără
Compușii volatili de potasiu colorează o flacără incoloră cu o caracteristică Violet... În prezența sărurilor de sodiu, culoarea violetă a flăcării devine invizibilă, deoarece compușii de sodiu colorează flacăra arzătorului în galben.
Reacții cu hexanitrocobaltat de sodiu (ΙΙΙ)
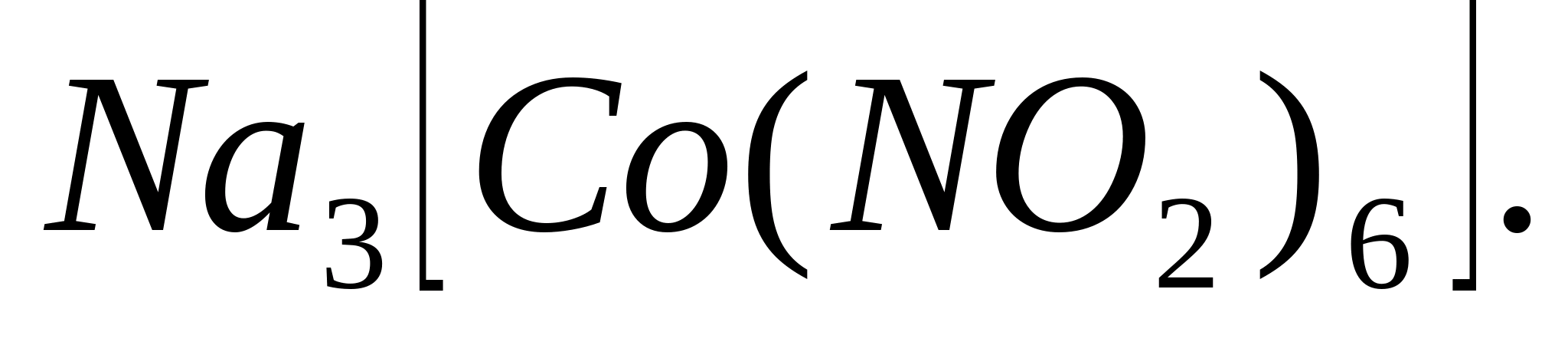
Puneți 1-2 picături dintr-o soluție de orice sare de potasiu într-o eprubetă, adăugați 3-5 picături de soluție de hexanitrocobaltat de sodiu (ΙΙΙ), adăugați câteva picături de 6 M acid aceticși frecați tija de sticlă de părțile laterale ale eprubetei. În acest caz, precipitat cristalin galben hexanitrocobaltat (ΙΙΙ) sodiu dipotasic 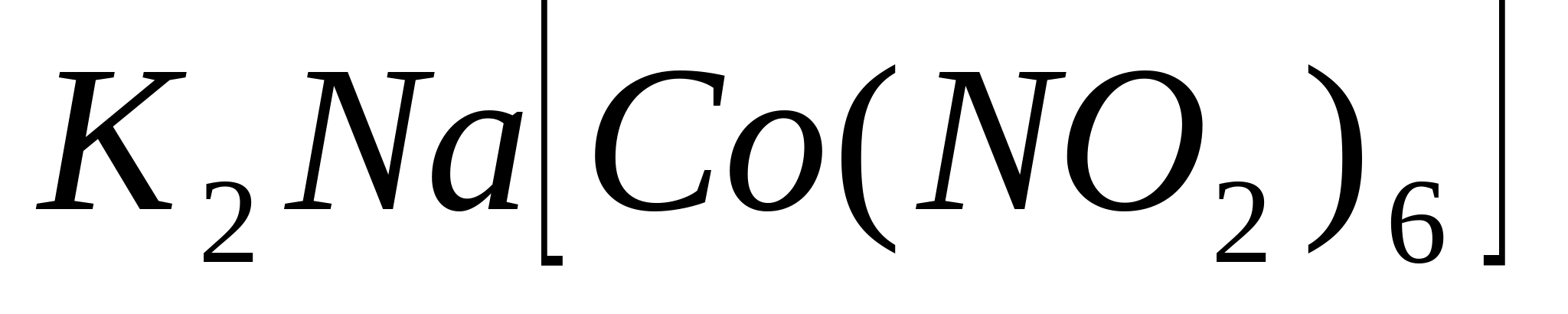 :
:
sau sub formă ionică:
Reacția trebuie efectuată în prezența acidului acetic diluat.
Reacția cu acid acid tartrat de sodiu
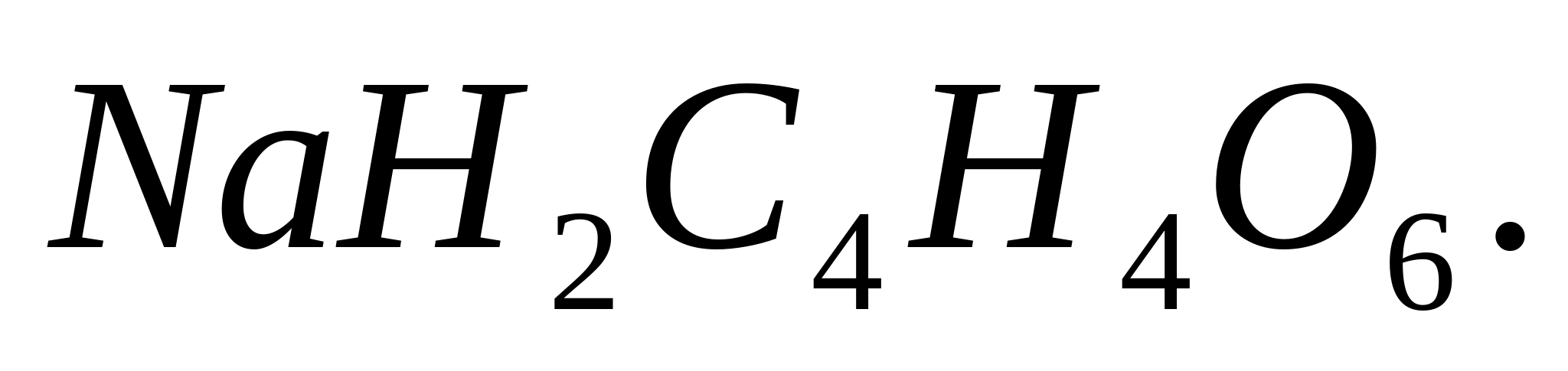
Se pun într-o eprubetă 2-3 picături dintr-o soluție de orice sare de potasiu, se adaugă 0,5 ml soluție de acid acid de tartrat de sodiu și se freacă cu o baghetă de sticlă de pereții eprubetei. După un timp, se va forma un precipitat cristalin alb:
sau sub formă ionică:
Condiții de reacție.

NH4+
Reacția cu reactivul lui Nessler
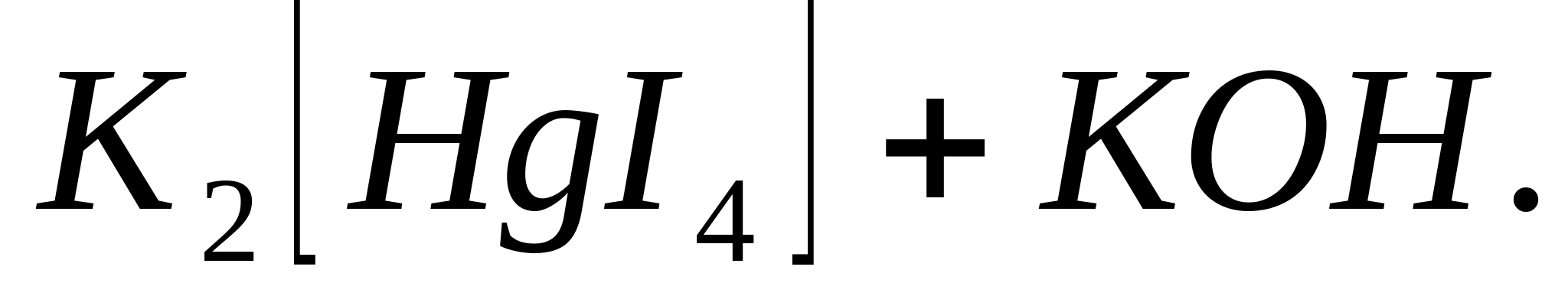
Adăugați la picătură
soluție de sare de amoniu diluată 1-2 picături de soluție de reactiv. In prezenta  - ioni, se formează un precipitat caracteristic roșu-brun; dacă există urme, soluția devine galbenă:
- ioni, se formează un precipitat caracteristic roșu-brun; dacă există urme, soluția devine galbenă:
sau sub formă ionică:
Alți cationi Ι ai grupului analitic nu interferează cu detectarea ionilor de amoniu de către reactivul Nessler.
Reacția cu alcalii
Pune câteva picături de soluție de sare de amoniu într-o eprubetă  și adăugați 5 picături dintr-o soluție apoasă din oricare dintre bazele tari -
și adăugați 5 picături dintr-o soluție apoasă din oricare dintre bazele tari -  - și încălziți conținutul eprubetei în flacăra unui arzător cu gaz. Datorită descompunerii sării de amoniu se va elibera amoniac:
- și încălziți conținutul eprubetei în flacăra unui arzător cu gaz. Datorită descompunerii sării de amoniu se va elibera amoniac:
sau sub formă ionică:
Amoniacul eliberat poate fi detectat în diferite moduri:
prin miros;
prin decolorarea albastră a hârtiei indicator universal umezită cu apă distilată și introdusă în vapori deasupra soluției;
prin formarea fumului de clorură de amoniu când se aduce la deschiderea eprubetei o baghetă de sticlă umezită cu o picătură de acid clorhidric (clorhidric) concentrat.
Fierberea cu alcaline caustice sau carbonați de sodiu sau potasiu
Sub acțiunea alcalinelor caustice sau a carbonaților de sodiu sau de potasiu, precum și la încălzire prelungită, sărurile de amoniu din soluții se descompun cu eliberarea de amoniac gazos.
Mg++
Acțiunea bazelor puternice.
Când se adaugă baze puternice la soluțiile de săruri de magneziu, sediment alb
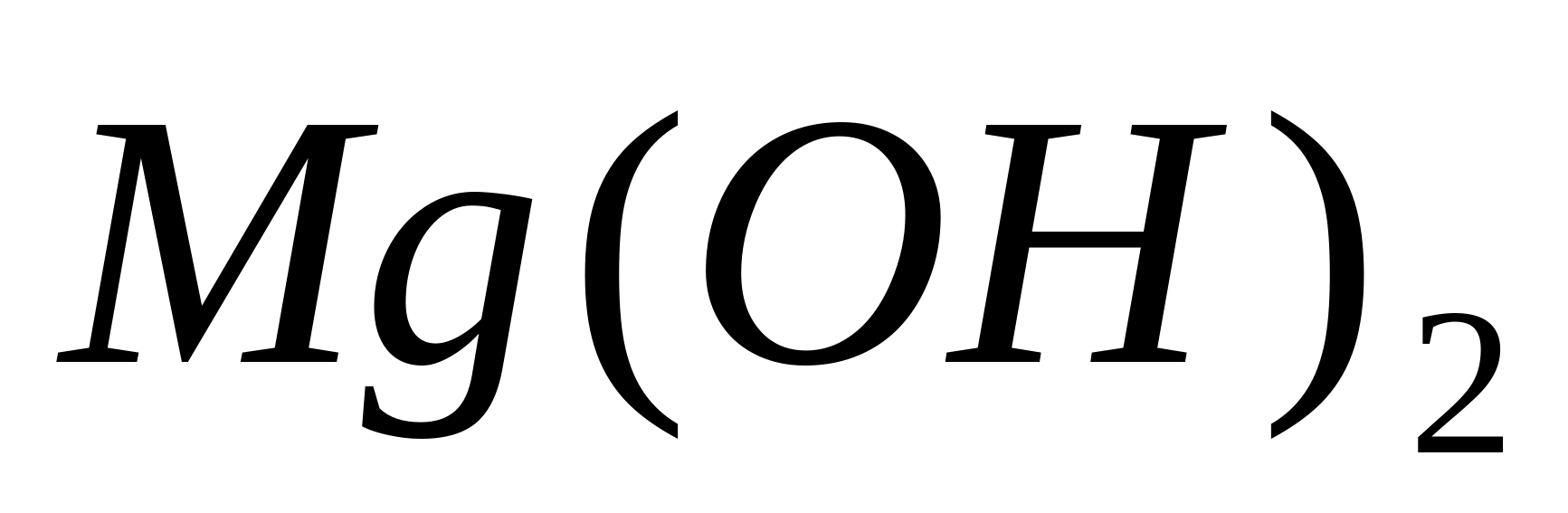 ... Când se adaugă o bază slabă (hidroxid de amoniu), precipitarea este incompletă, iar în prezența sărurilor de amoniu nu se formează deloc precipitat. Prin urmare, sărurile de amoniu trebuie mai întâi îndepărtate din soluție.
... Când se adaugă o bază slabă (hidroxid de amoniu), precipitarea este incompletă, iar în prezența sărurilor de amoniu nu se formează deloc precipitat. Prin urmare, sărurile de amoniu trebuie mai întâi îndepărtate din soluție.
Pune câteva picături de soluție într-o eprubetă MgCl 2
, adăugați câteva picături dintr-o soluție apoasă a uneia dintre bazele tari -. Va precipita Mg(EL) 2
.
Într-o altă eprubetă la soluție MgCl 2
in loc de 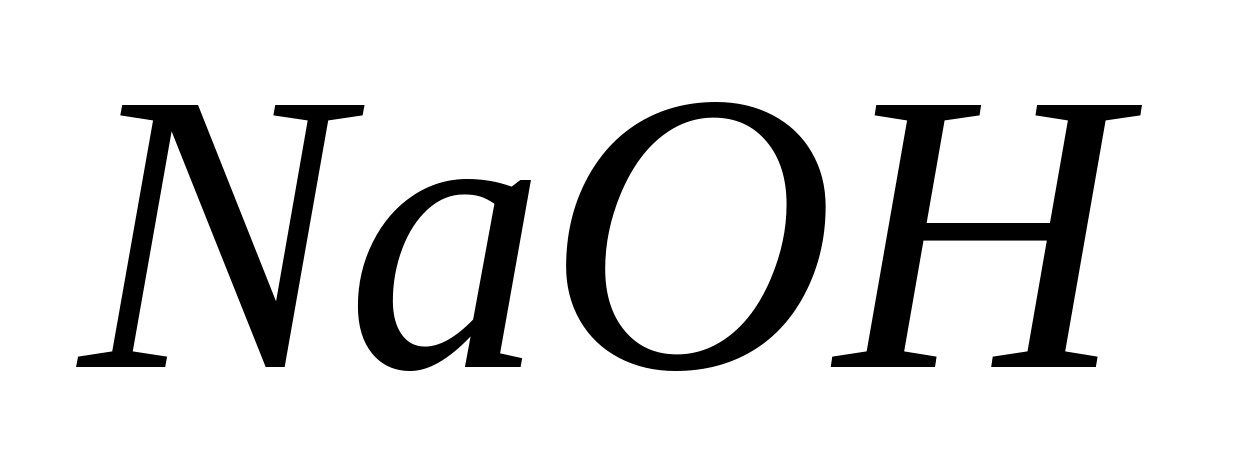 se adaugă soluție de hidroxid de amoniu. Observați care tub are cele mai multe sedimente.
se adaugă soluție de hidroxid de amoniu. Observați care tub are cele mai multe sedimente.
Reacția cu monohidrogenofosfat de sodiu

Reacție microcristaloscopică.
D ![]() pentru detectarea microcristaloscopică
pentru detectarea microcristaloscopică 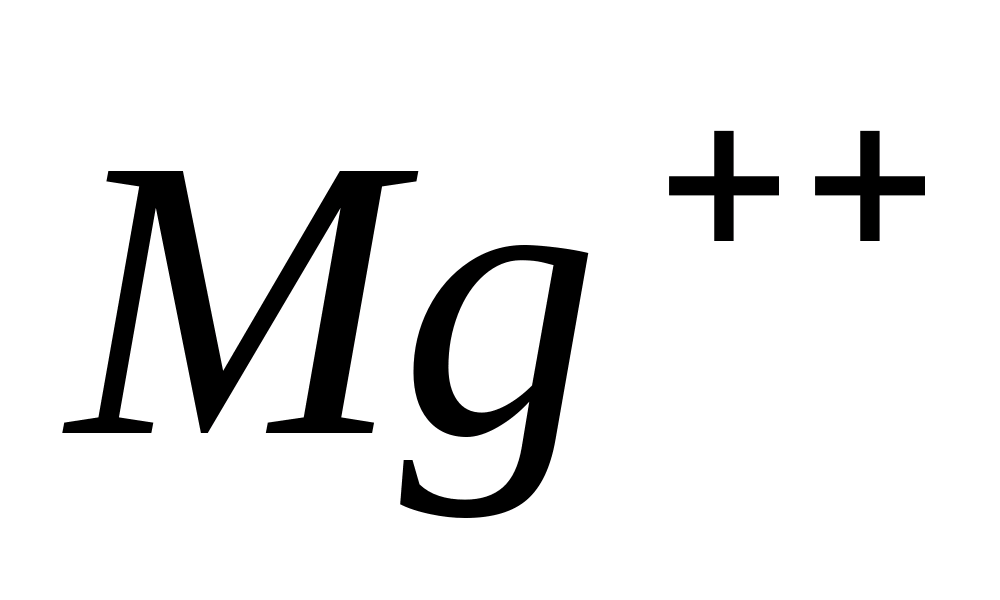 - ioni sub formă
- ioni sub formă  pune o picătură de soluție
pune o picătură de soluție  pe diapozitiv
... Apoi adăugați la acesta dintr-o pipetă capilară mai întâi o picătură de soluție
pe diapozitiv
... Apoi adăugați la acesta dintr-o pipetă capilară mai întâi o picătură de soluție 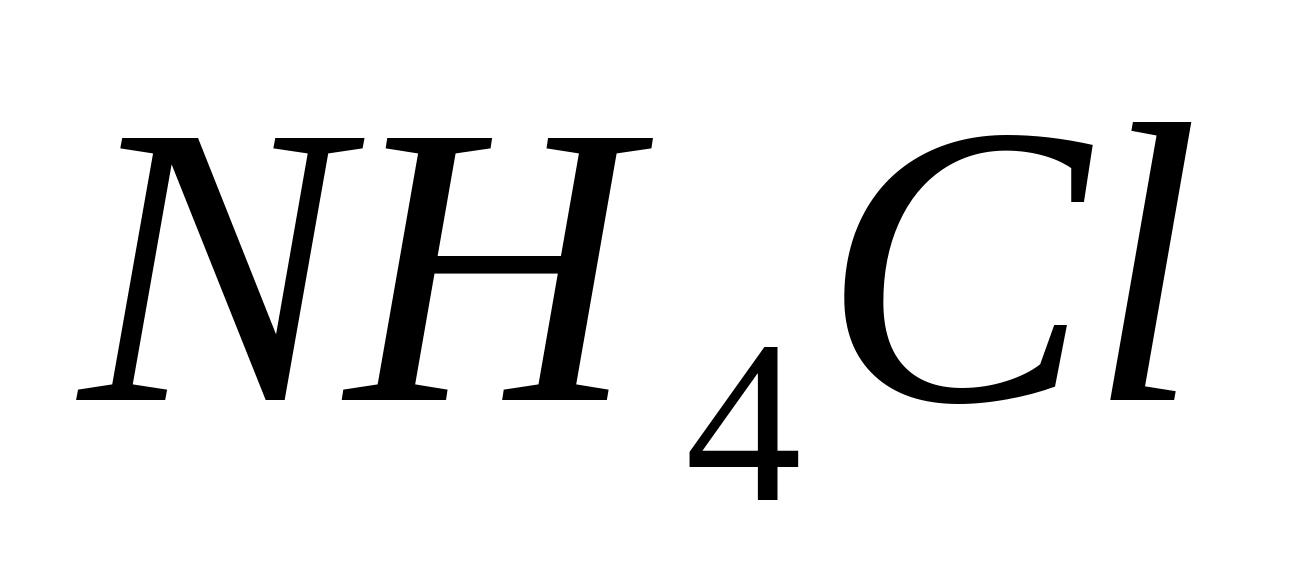 , apoi o picătură de soluție apoasă concentrată de amoniac. La final, adăugați cristalul în soluție.
, apoi o picătură de soluție apoasă concentrată de amoniac. La final, adăugați cristalul în soluție. 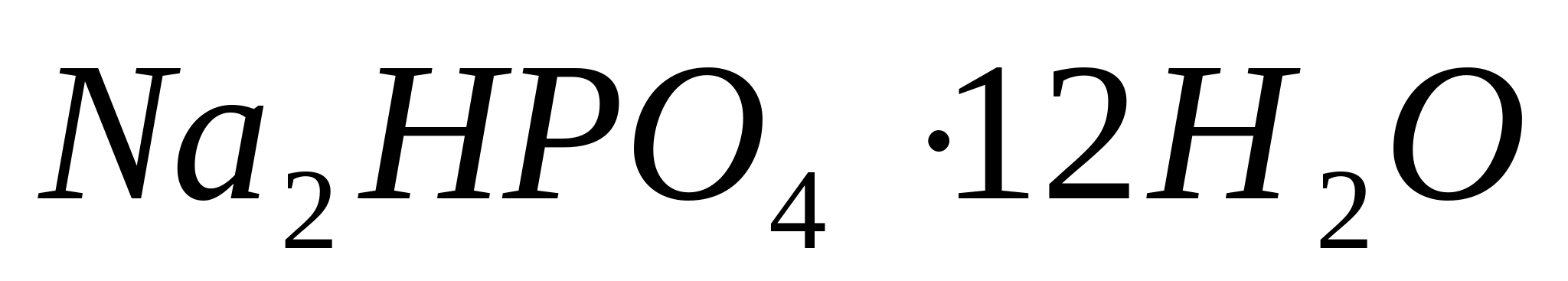 (fosfat acid de sodiu). Se recomandă încălzirea lamei de sticlă. În imediata apropiere a cristalului de fosfat de sodiu apar, la o distanță mai mare, cristale dendritice - cristale corect formate sub formă de stele cu șase raze. - fosfat de magneziu amoniu
(fosfat acid de sodiu). Se recomandă încălzirea lamei de sticlă. În imediata apropiere a cristalului de fosfat de sodiu apar, la o distanță mai mare, cristale dendritice - cristale corect formate sub formă de stele cu șase raze. - fosfat de magneziu amoniu 
sau sub formă ionică
Examinați cristalele la microscop.
Ca++
Reacția cu oxalat de amoniu.
Puneți 1-2 picături dintr-o soluție de sare de calciu într-o eprubetă, de exemplu 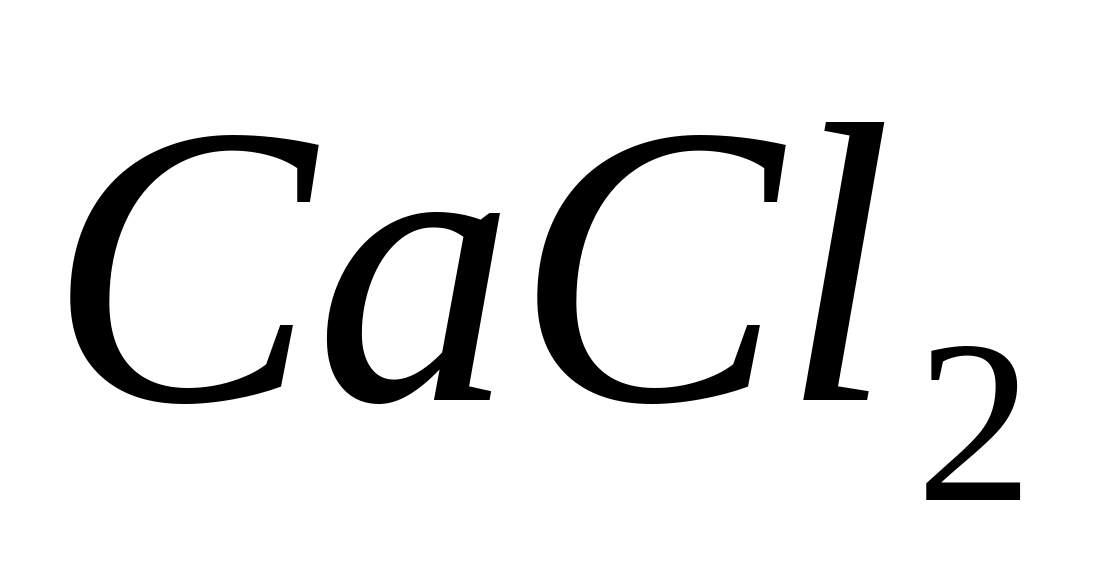 , și adăugați 1-2 picături de acid acetic astfel încât reacția mediului să fie acidă (în cazul indicatorului roșu de metil, culoarea ar trebui să devină portocalie). Adăugați câteva picături de soluție de oxalat de amoniu
, și adăugați 1-2 picături de acid acetic astfel încât reacția mediului să fie acidă (în cazul indicatorului roșu de metil, culoarea ar trebui să devină portocalie). Adăugați câteva picături de soluție de oxalat de amoniu  În acest caz, dintr-o soluție concentrată imediat și dintr-o soluție diluată scade treptat precipitat cristalin fin alb
În acest caz, dintr-o soluție concentrată imediat și dintr-o soluție diluată scade treptat precipitat cristalin fin alb
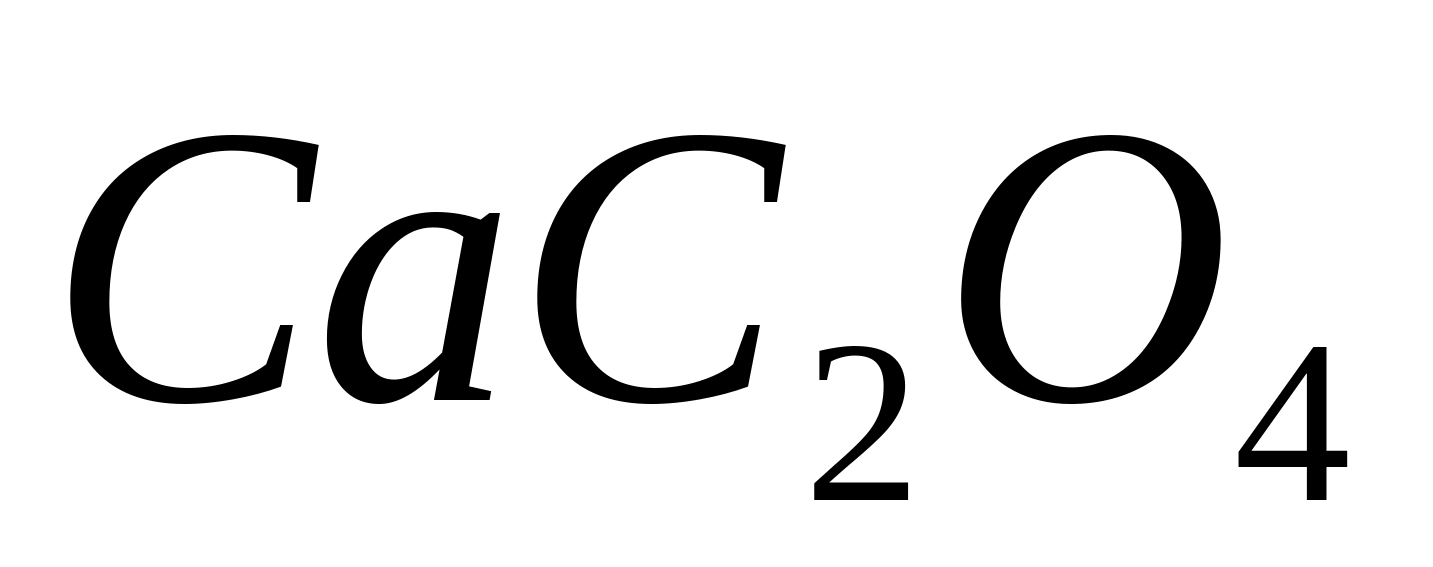 ... In prezenta
... In prezenta  oxalatul de calciu este precipitat cantitativ:
oxalatul de calciu este precipitat cantitativ:
sau sub formă ionică:
Reacție microcristaloscopică cu acid sulfuric .
NS 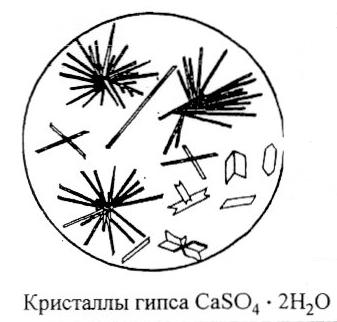 Pune o picătură de soluție de clorură de calciu pe o lamă de sticlă, apoi adaugă o picătură de soluție diluată
Pune o picătură de soluție de clorură de calciu pe o lamă de sticlă, apoi adaugă o picătură de soluție diluată 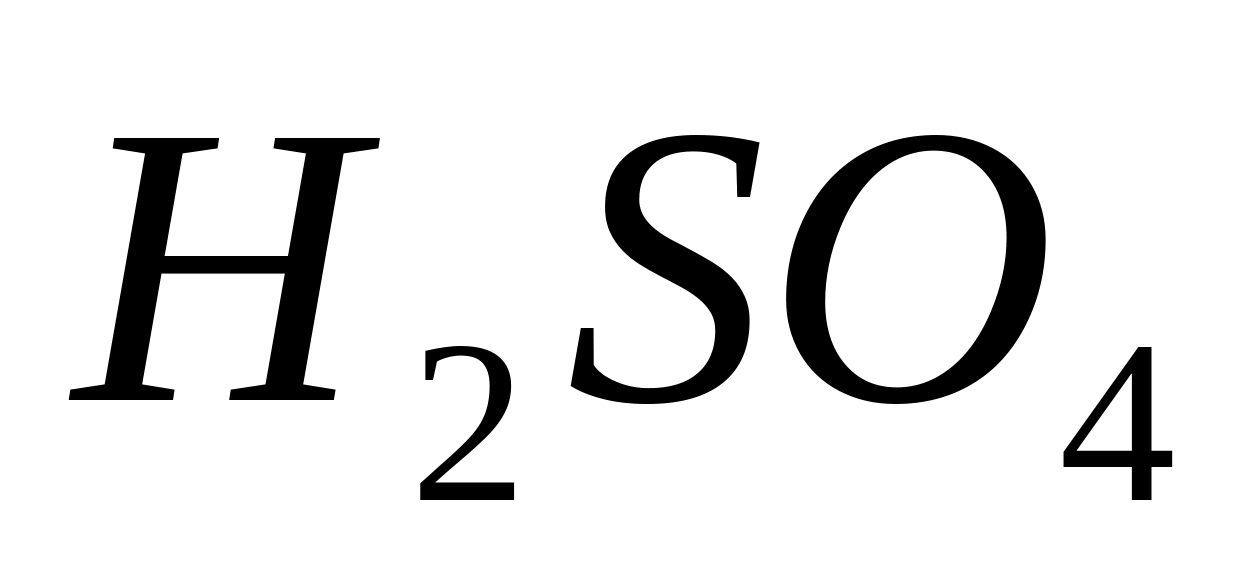 si se evapora usor amestecul. În acest caz, ciorchine caracteristice frumoase de ace –
cristale de gips
si se evapora usor amestecul. În acest caz, ciorchine caracteristice frumoase de ace –
cristale de gips 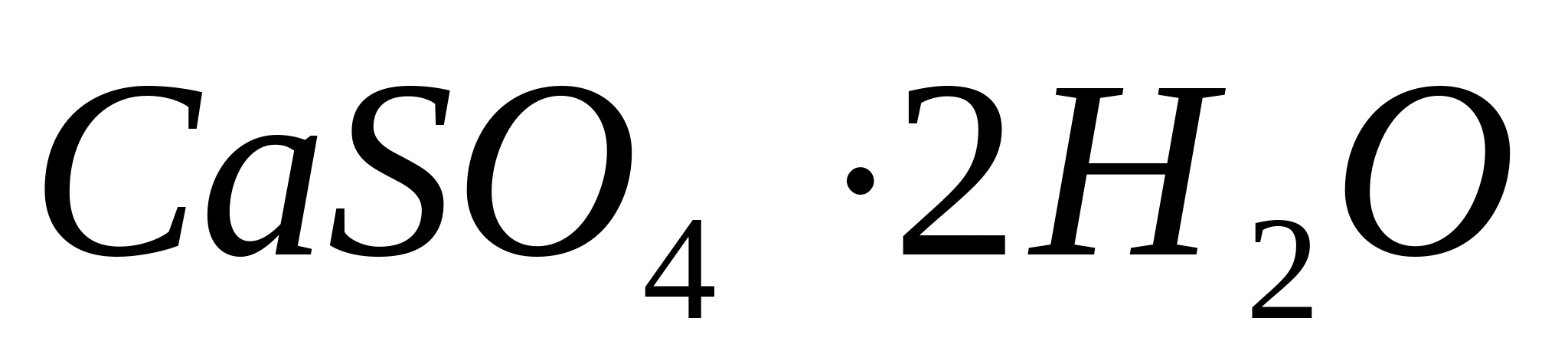 ,
ușor de distins la microscop.
,
ușor de distins la microscop.
Reacție de colorare la flacără
Ionii de calciu colorează flacăra incoloră într-o culoare roșu cărămidă.
Ba ++
Reacția cu cromat de potasiu (sau dicromat) .
Puneți 1-2 picături dintr-o soluție de sare de bariu într-o eprubetă, de exemplu  , și adăugați câteva picături de soluție
, și adăugați câteva picături de soluție  sau
sau 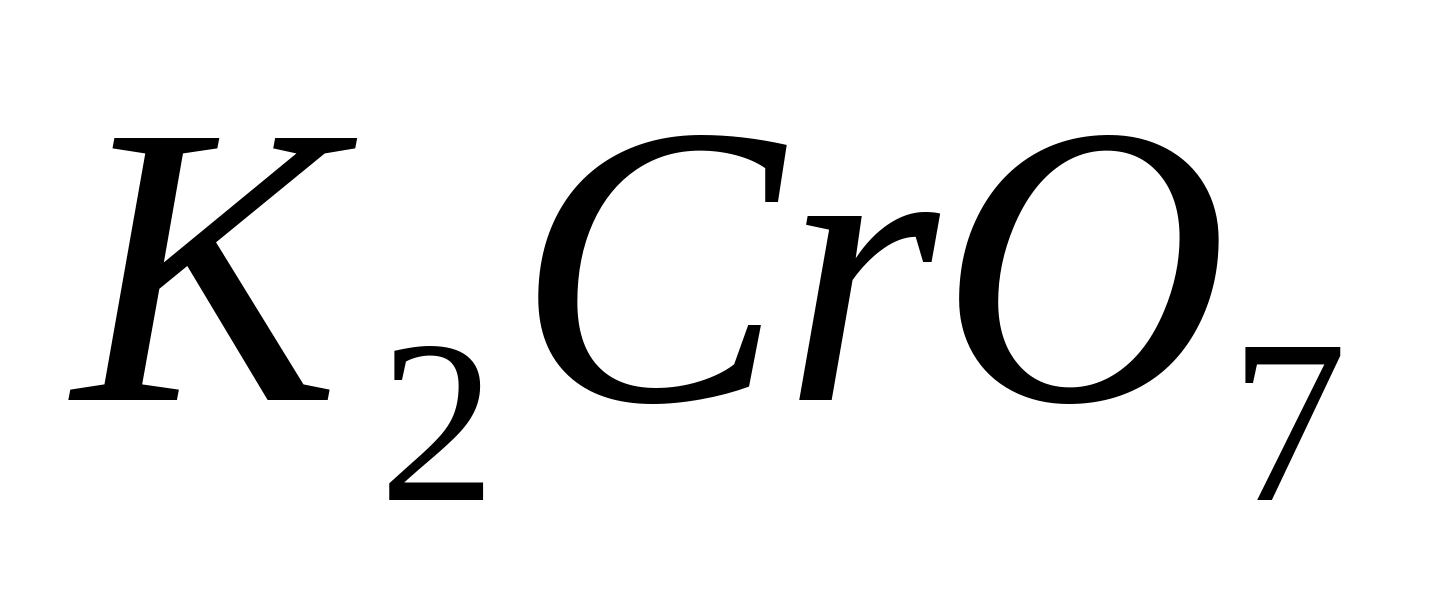 ... Se încălzește eprubeta peste flacăra unui arzător. În același timp, precipitat cristalin galben:
... Se încălzește eprubeta peste flacăra unui arzător. În același timp, precipitat cristalin galben:
sau sub formă ionică:
sau sub formă ionică:
2![]()
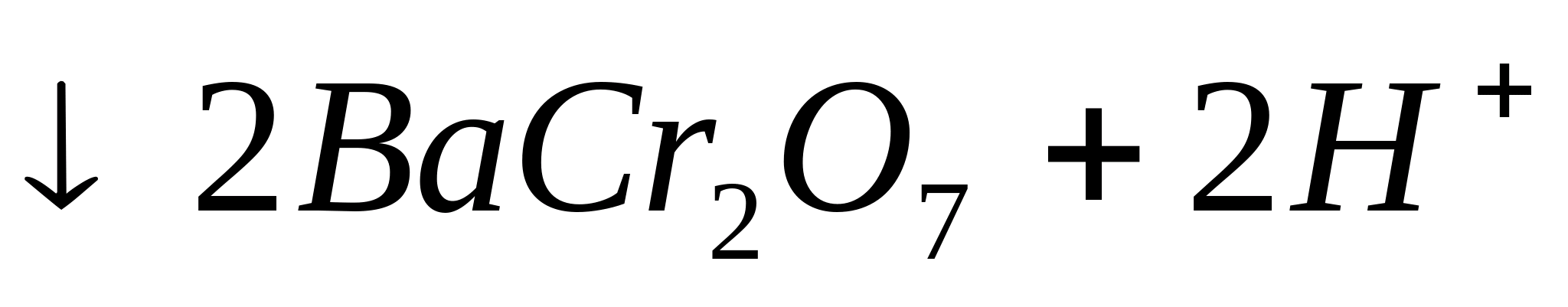
Reacția de picătură cu rodizonat de sodiu.
Se pune o picătură dintr-o soluție de testare neutră pe o hârtie de filtru și apoi o picătură dintr-o soluție apoasă de rodizonat de sodiu. Format rosu maro precipitat de rodizonat de bariu:

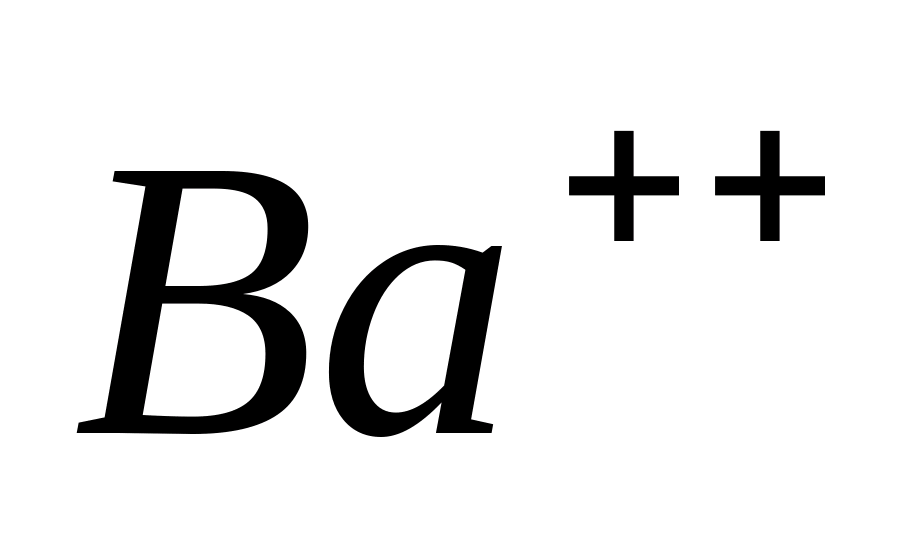 +
+


 +
+
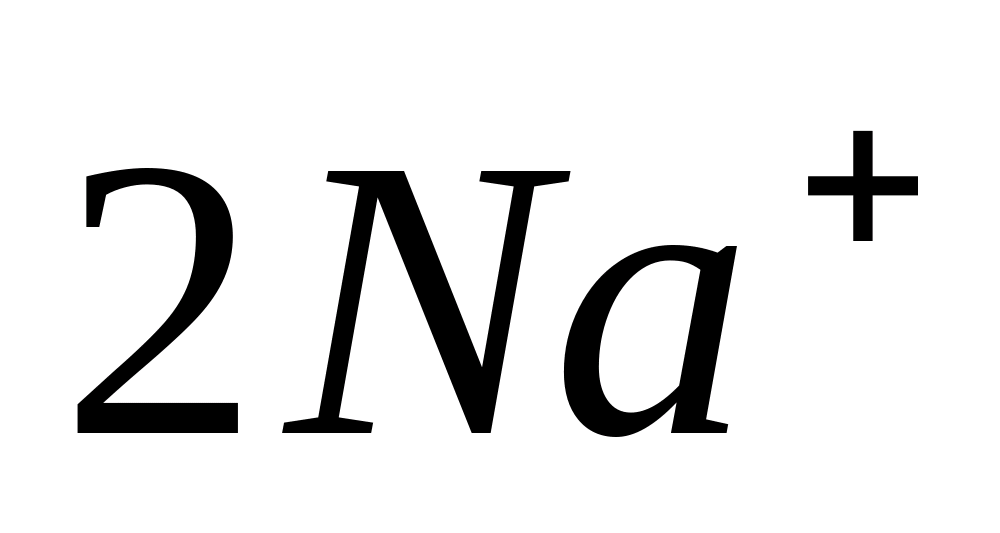

Rodizonatul de bariu la rece în acid clorhidric se transformă în rodizonat de hidrogen de bariu de culoare roșu aprins:
Reacție de colorare la flacără.
O flacără incoloră este colorată de ionii de bariu culoare galben-verde.
Reacție cu acid sulfuric sau sulfat de amoniu.
Pune câteva picături de sare de bariu solubilă în apă într-o eprubetă, de exemplu
clorură de bariu, se adaugă 1 ml de acid sulfuric diluat sau soluție de sulfat de amoniu. În același timp, precipitat cristalin alb sulfat de bariu 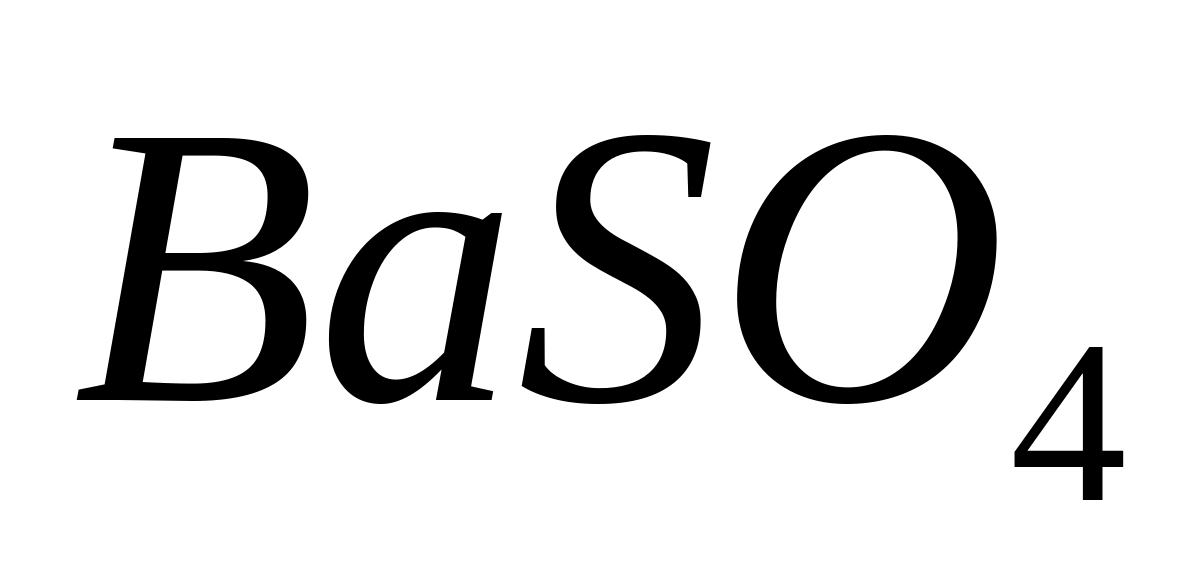 .
.
Al +++
Reacția cu hidroxid de amoniu.
Puneți 1 ml de soluție de sare de aluminiu într-o eprubetă, de exemplu  , adăugați câteva picături de soluție de hidroxid de amoniu și încălziți. În același timp, alb arefigurativsedimenthidroksidaaluminiu:
, adăugați câteva picături de soluție de hidroxid de amoniu și încălziți. În același timp, alb arefigurativsedimenthidroksidaaluminiu:
sau sub formă ionică:
Se transferă precipitatul de hidroxid de aluminiu împreună cu soluția într-un tub de centrifugă și se centrifugă. Scurgeți soluția limpede și împărțiți precipitatul în două părți.
Efectuați următoarele reacții de testare:
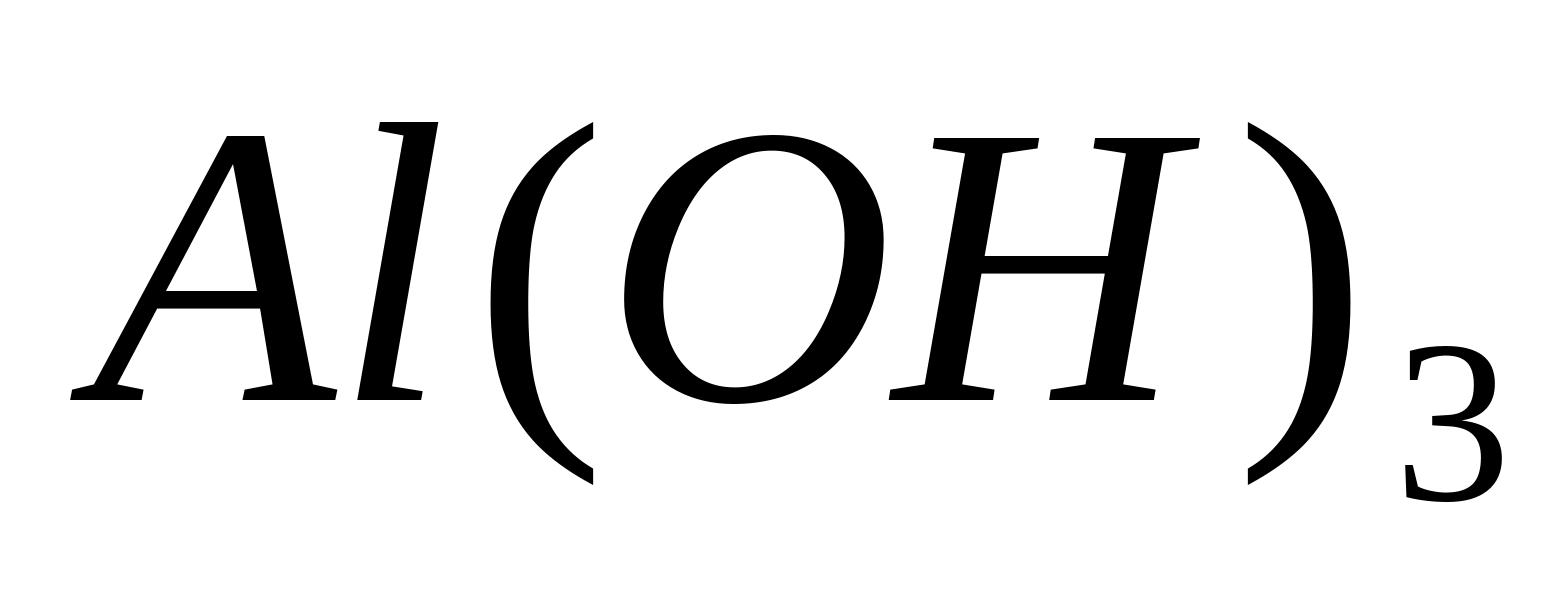

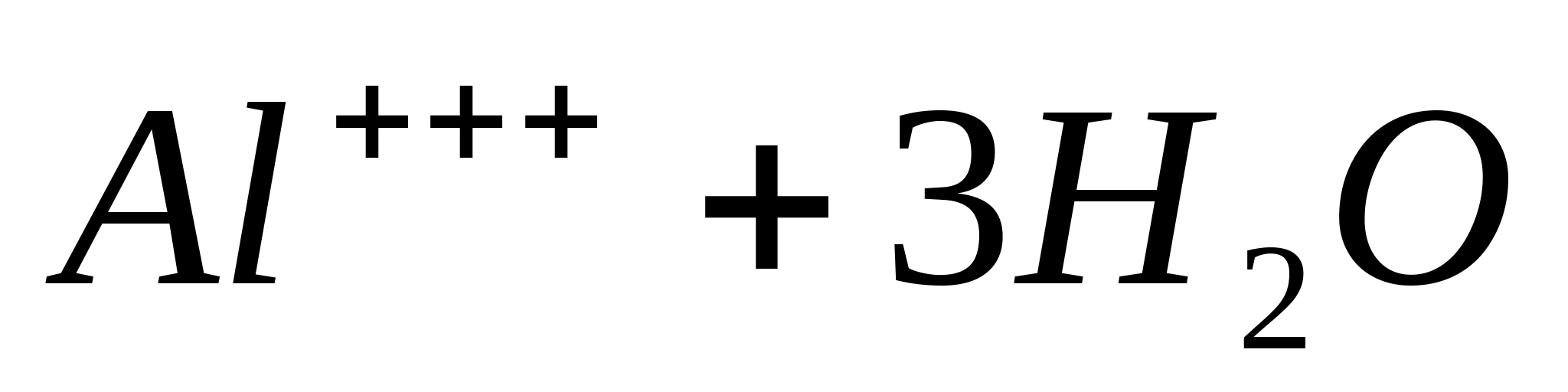
Prin urmare, este un compus amfoter tipic.
Reacția cu alizarina (1,2-dioxiantrachinonă)
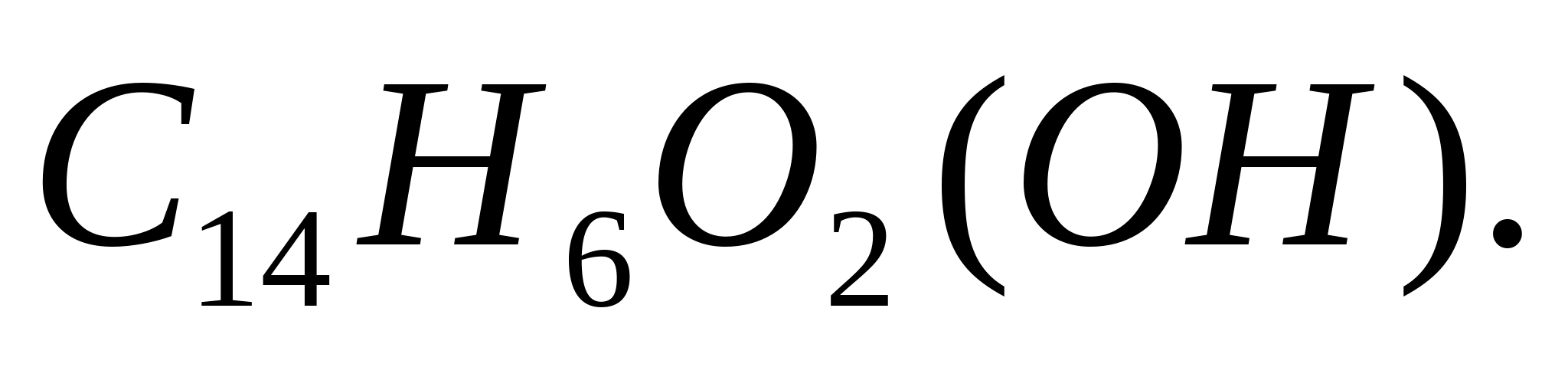
Reacția în eprubetă. Se pun într-o eprubetă 2 picături dintr-o soluție de sare de aluminiu și se adaugă 5 picături  ... Aceasta va forma un precipitat. Adăugați câteva picături de soluție de alizarina proaspăt preparată la precipitatul rezultat și fierbeți. Alizarina formează cu hidroxid de aluminiu un compus de culoare roșie intensă, numit lac de aluminiu. Lacul de aluminiu nu se dizolvă în acid acetic diluat. Prin urmare, după răcirea conținutului eprubetei, se adaugă puțin acid acetic până la o reacție slab acidă (pH ~ 4-5). În prezența ionilor de aluminiu, precipitatul roșu nu dispare.
... Aceasta va forma un precipitat. Adăugați câteva picături de soluție de alizarina proaspăt preparată la precipitatul rezultat și fierbeți. Alizarina formează cu hidroxid de aluminiu un compus de culoare roșie intensă, numit lac de aluminiu. Lacul de aluminiu nu se dizolvă în acid acetic diluat. Prin urmare, după răcirea conținutului eprubetei, se adaugă puțin acid acetic până la o reacție slab acidă (pH ~ 4-5). În prezența ionilor de aluminiu, precipitatul roșu nu dispare.
Condiții de reacție.
Când se efectuează o reacție în eprubetă, valoarea pH-ului la începutul precipitării trebuie să depășească 7, corespunzătoare unei soluții slabe de amoniac, iar după precipitare, pH-ul poate fi mai mic de 7, corespunzătoare unei soluții de acid acetic diluat (pH = 4). -5).
Reacția se realizează prin fierbere.
Prezența precipitatelor altor hidroxizi, chiar și în cantități mici, este nedorită, iar în cantități mari este inacceptabilă.
Cr +++
Oxidarea C r +3 crom in Cr +6
Puneți într-o eprubetă 2-3 picături dintr-o soluție de sulfat sau nitrat de crom (III), adăugați 5 picături de peroxid de hidrogen.  , 3-5 picături hidroxid de potasiu KOH. Se încălzește amestecul la fierbere.
, 3-5 picături hidroxid de potasiu KOH. Se încălzește amestecul la fierbere.
În acest caz, are loc oxidarea 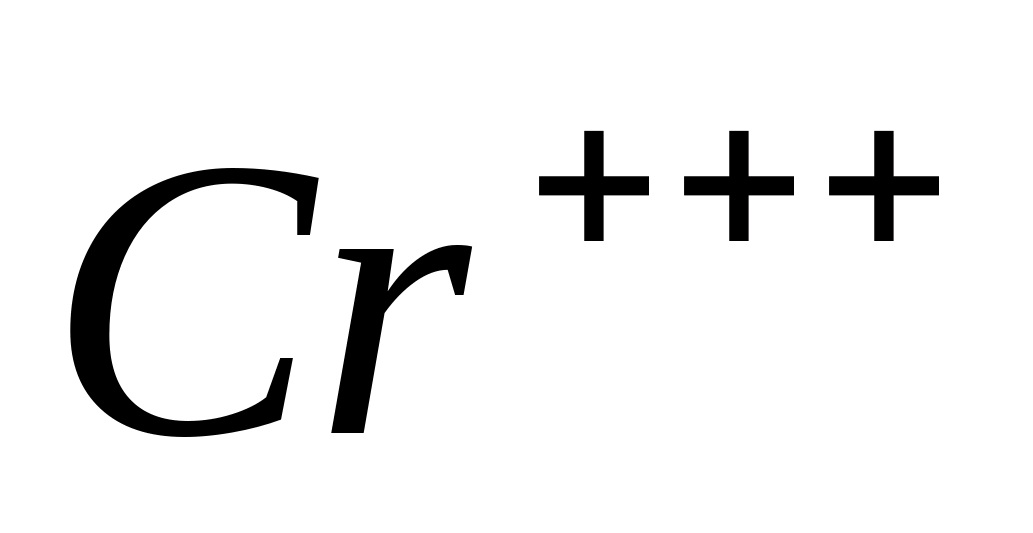 -ioni la
-ioni la  -ioni si colorant din albastru verde intră în galben.
-ioni si colorant din albastru verde intră în galben.
Cu soluția rezultată, efectuați următoarele reacții de verificare pentru a confirma formarea de ioni β.
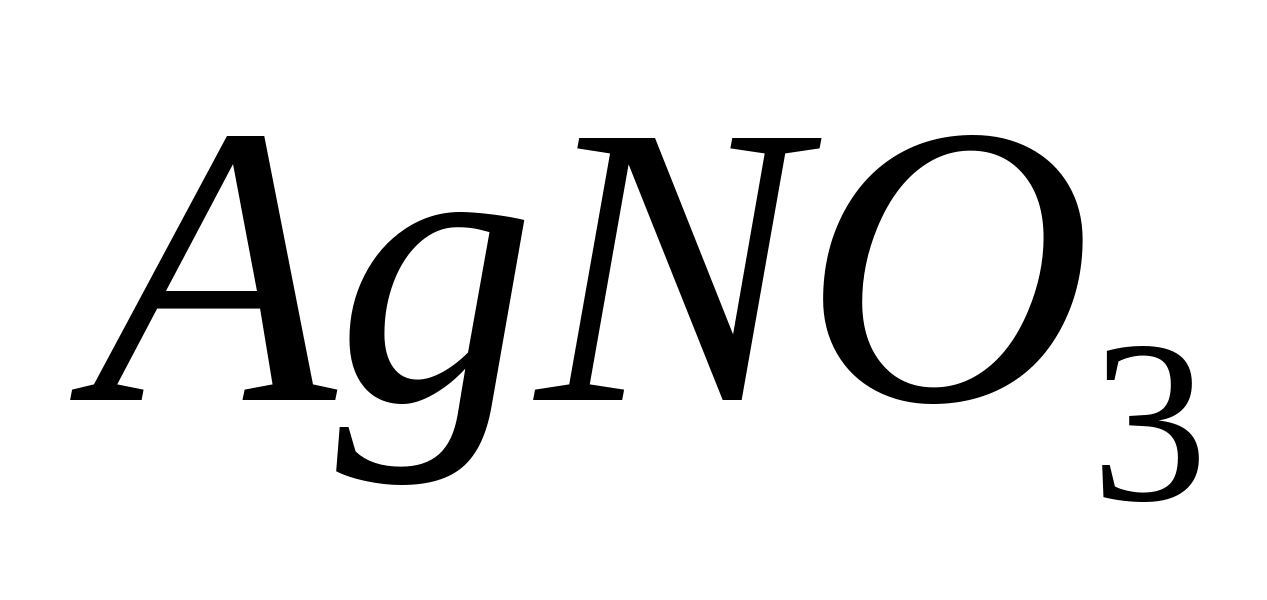
Fe +++
Reacția cu 
Puneți 1-2 picături de soluție într-o eprubetă sau pe o lamă de sticlă 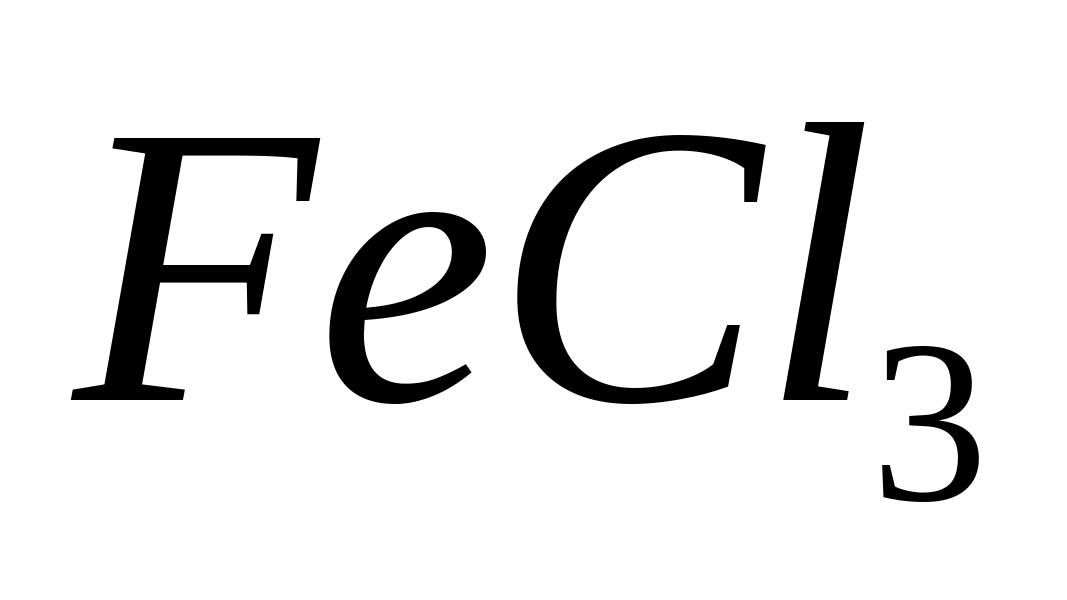 , acidulați soluția cu 1-2 picături de acid clorhidric, adăugați 2-3 picături de sare galbenă de sânge - o soluție de hexacianoferat de potasiu (II)
, acidulați soluția cu 1-2 picături de acid clorhidric, adăugați 2-3 picături de sare galbenă de sânge - o soluție de hexacianoferat de potasiu (II)
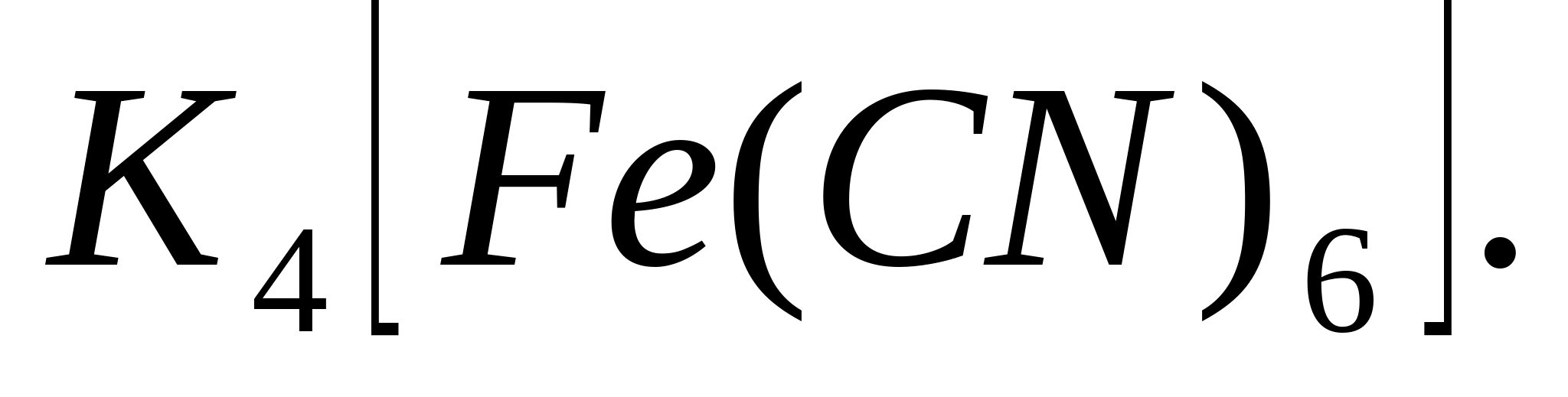 În același timp, sediment albastru de Prusia albastru închis:
În același timp, sediment albastru de Prusia albastru închis:
Reacția cu tiocianat de amoniu.
Se pune 1 ml de soluție într-o eprubetă, se diluează cu cinci picături de apă distilată și se adaugă 3-5 picături de soluție de tiocianat de amoniu
 ... În același timp, apare colorare roșie sânge:
... În același timp, apare colorare roșie sânge:
sau sub formă ionică:
Reacție cu hidroxid de sodiu, potasiu sau amoniu.
Sub acţiunea soluţiilor  și
pe ioni
și
pe ioni  format sediment roșu maroniu Fe (OH) s, solubil în acizi:
format sediment roșu maroniu Fe (OH) s, solubil în acizi:
Fe ++
Reacția cu 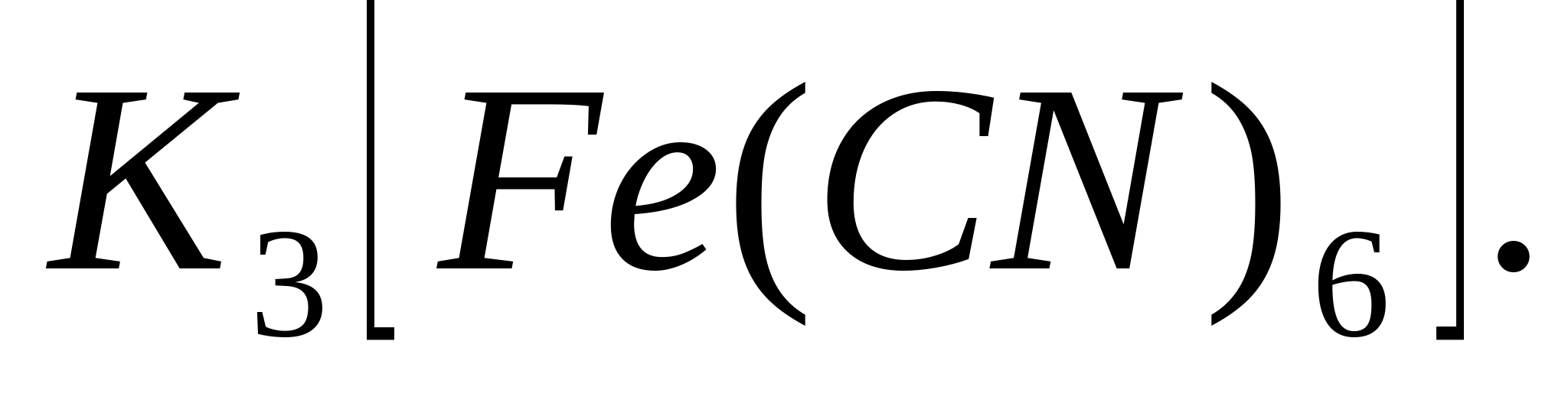
Puneți 1-2 picături de soluție într-o eprubetă sau pe o lamă de sticlă FeSO 4 , adăugați 2-3 picături sare roșie din sânge - soluție de hexacianoferat de potasiu (III) În același timp, formația albastru turnboolean:
Zn ++
Reacție cu hidroxid de sodiu, potasiu și amoniu.
Când hidroxidul de sodiu sau de potasiu acționează asupra clorurii de zinc, sediment alb Zn(OH) 2 , solubil în exces și.
Obțineți un precipitat de hidroxid de zinc într-o eprubetă, separați-l de soluție folosind o centrifugă. Împărțiți sedimentul în două părți. Se dizolvă o parte din precipitat în soluția acidă, cealaltă în soluția de bază. Notați ecuațiile de reacție pentru a confirma amfoteritatea hidroxidului de zinc.
Reacții Mn ++
Reacția cu hidroxid de sodiu și peroxid de hidrogen.
Ionii de mangan sunt caracterizați prin reacții de oxidare-reducere.
Una dintre reacțiile de oxidare caracteristice 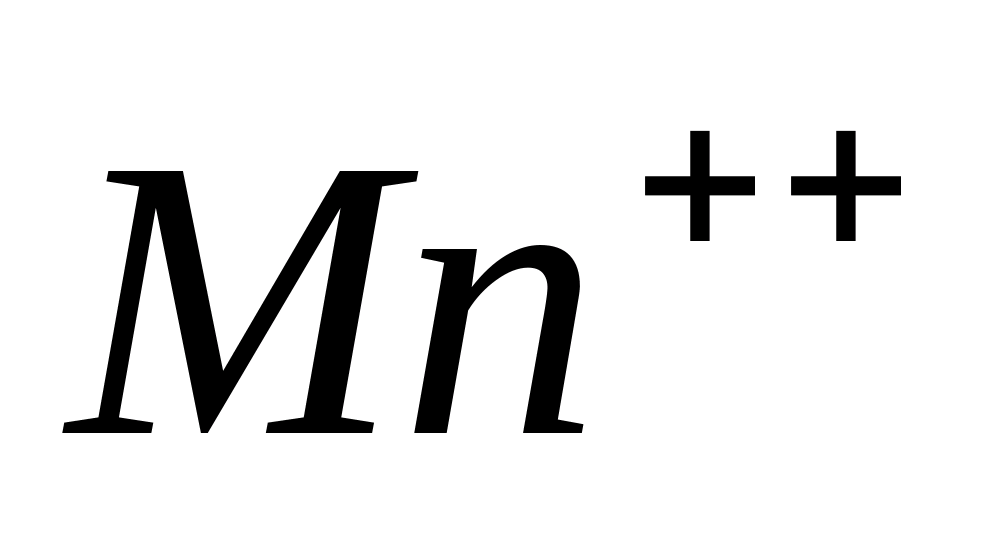 într-un mediu alcalin este interacţiunea acestuia cu. Sub acțiunea peroxidului de hidrogen într-un mediu alcalin, ionii incolori de mangan (II) sunt oxidați în compuși insolubili de mangan (IV).
într-un mediu alcalin este interacţiunea acestuia cu. Sub acțiunea peroxidului de hidrogen într-un mediu alcalin, ionii incolori de mangan (II) sunt oxidați în compuși insolubili de mangan (IV).  sau
sau 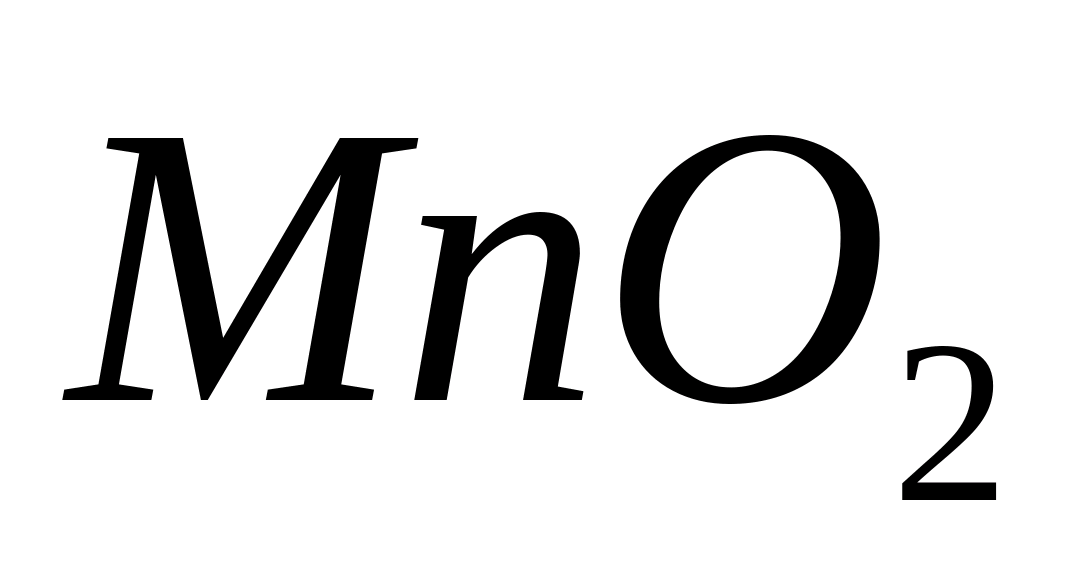 colorat maro:
colorat maro:
sau sub formă ionică
Se efectuează oxidarea ionilor β la. Pentru a face acest lucru, puneți 1-3 picături dintr-o soluție de orice sare de mangan într-o eprubetă și adăugați câteva picături de soluție de NaOH. Se formează un precipitat alb de hidroxid de mangan, care devine încet maroniu din cauza oxidării în aer:
Adăugați câteva picături în sedimentul rezultat. Precipitatul devine instantaneu maro-negru din cauza oxidării rapide a ionilor de mangan (II).
Condiții de reacție.
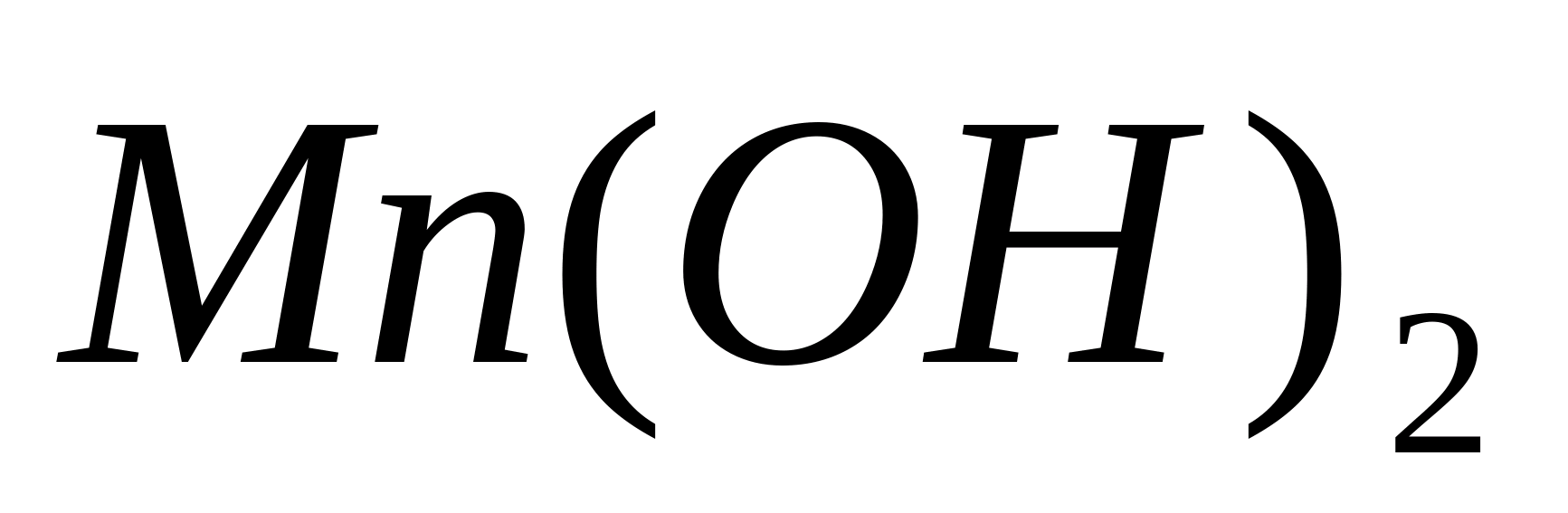
Oxidare
-ioni la
 - -ionii în mediu acid.
- -ionii în mediu acid.
Compușii manganului (II) sunt oxidați într-un mediu acid de oxidanți puternici la acid manganic. Una dintre cele mai importante reacții de oxidare în mediul acid azotic sau acid sulfuric este interacțiunea ionilor - cu  sau
sau  ... În acest caz, compușii incolori ai manganului divalent () sunt oxidați în compuși de mangan cu o stare de oxidare de +7 (
... În acest caz, compușii incolori ai manganului divalent () sunt oxidați în compuși de mangan cu o stare de oxidare de +7 ( 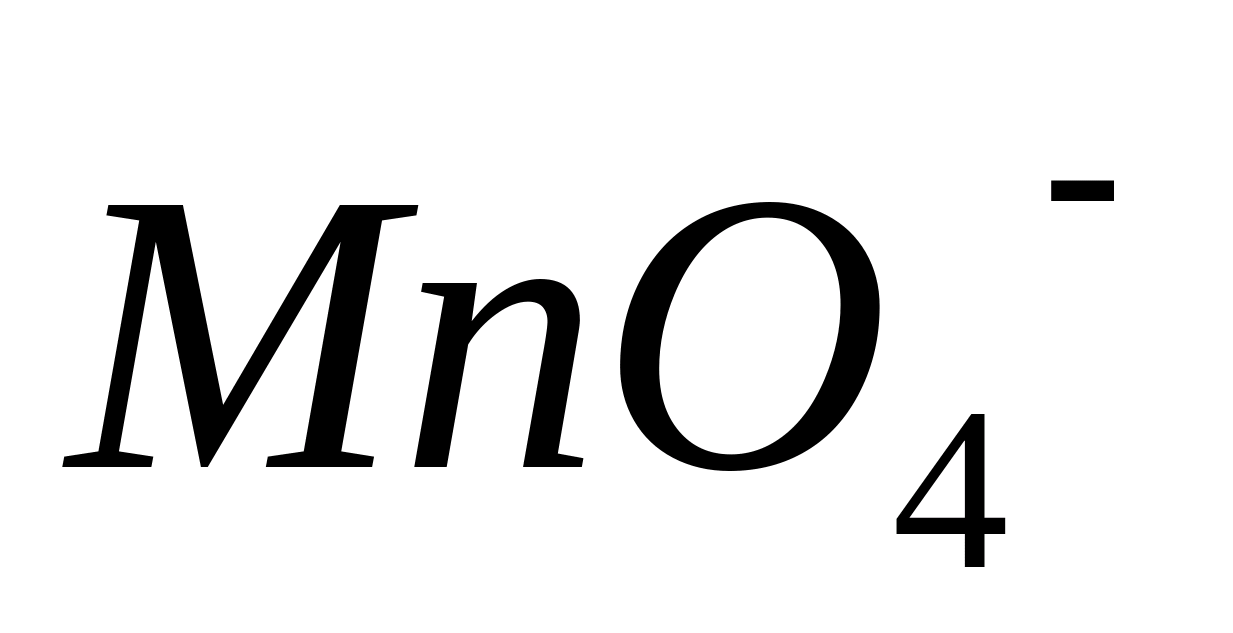 ), colorate violet-rosu:
), colorate violet-rosu:
sau sub formă ionică:
În prezența agenților reducători, inclusiv 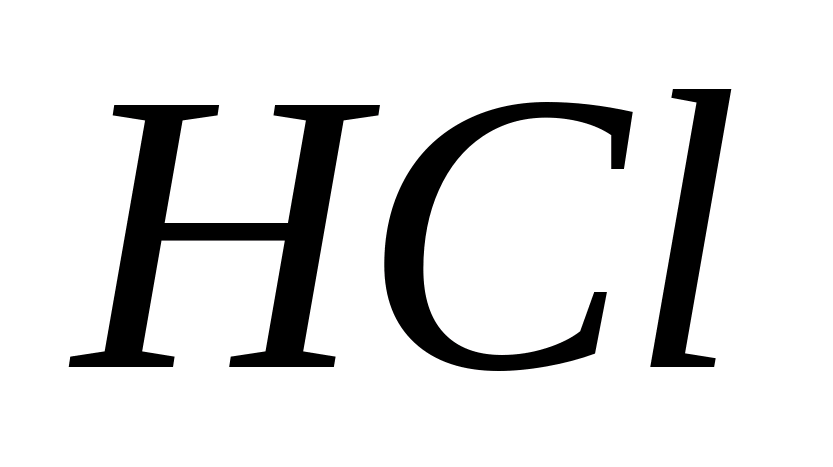 , are loc o reducere a oxidanților și. Prin urmare, soluțiile nu pot fi acidificate cu acid clorhidric.
, are loc o reducere a oxidanților și. Prin urmare, soluțiile nu pot fi acidificate cu acid clorhidric.
Efectuați oxidarea -ionilor în -ioni. Pentru a face acest lucru, puneți 1-2 picături dintr-o soluție de orice sare de mangan (nitrat sau sulfat, dar nu clorura !), se adaugă 5 picături de acid azotic diluat (1: 1), se adaugă o cantitate mică de agent de oxidare (dioxid de plumb) și se încălzește amestecul până la fierbere. Se toarnă 1-2 ml de apă distilată într-o eprubetă, fără a amesteca, conținutul eprubetei și se lasă amestecul să stea puțin. Apare o culoare roșie-zmeură, cauzată de acidul manganic format. Deoarece poate conține compuși de mangan sub formă de impuritate, se recomandă realizarea unui experiment martor, respectând aceleași condiții, dar fără a adăuga soluția de testare în eprubetă. În absența impurităților, culoarea nu apare.
Reacția de oxidare descrisă la acidul manganic este o reacție foarte sensibilă.
Condiții de reacție

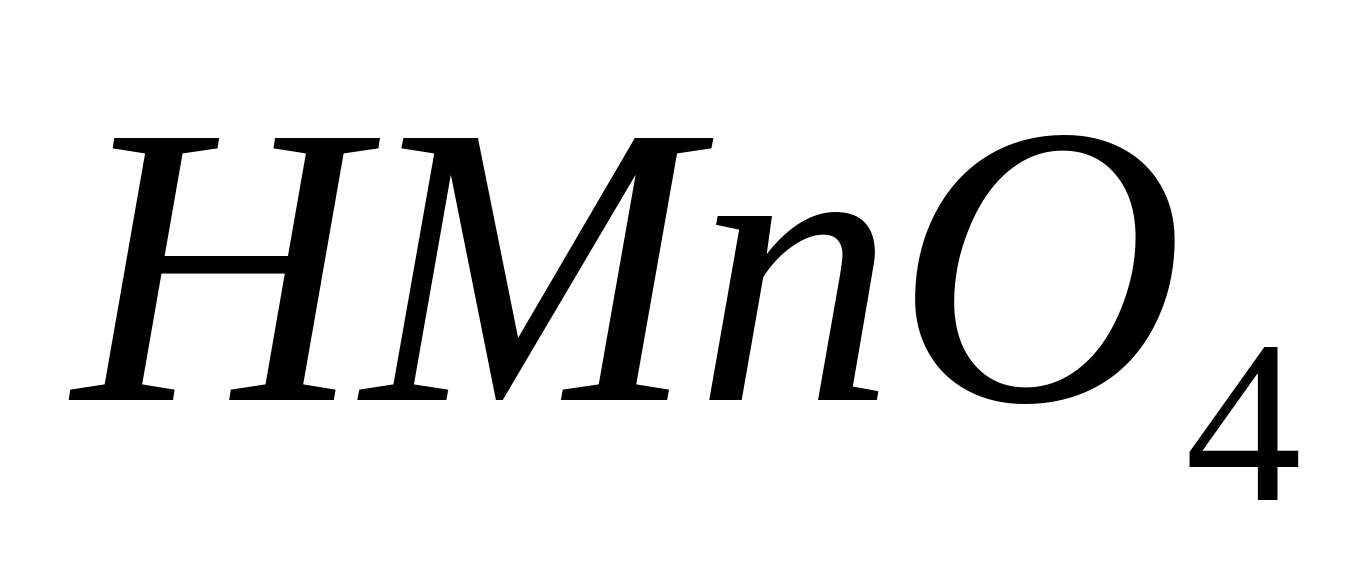
Analiza calitativă a anionilor
Cl -
Reacția cu nitrat de argint
Adăugați câteva picături de acid azotic și soluție la 1-2 ml de soluție de clorură de sodiu sau potasiu.  ... În prezența ionilor Cl -, un precipitat alb de AgCl precipită:
... În prezența ionilor Cl -, un precipitat alb de AgCl precipită:
Precipitatul se întunecă la lumină. Pentru a vă asigura că precipitatul rezultat conține într-adevăr AgCl, deoarece alți ioni dau precipitate similare, clătiți precipitatul cu apă distilată și centrifugați. Scurgeți apa. Se adaugă soluție de amoniac la precipitatul rezultat. În acest caz, AgCl se dizolvă, formând un cation complex 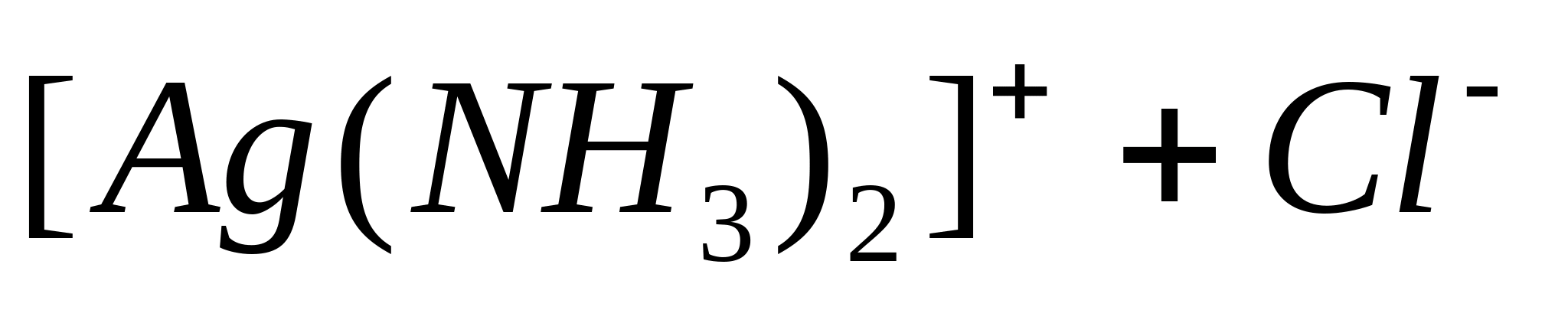 .
.
La soluția de compus complex, adăugați soluția diluată  ... Ionul complex este distrus și AgCl precipită din nou. Apariția unui precipitat este o dovadă a prezenței ionilor Cl - în analit. Reacțiile descrise au loc conform următoarelor ecuații:
... Ionul complex este distrus și AgCl precipită din nou. Apariția unui precipitat este o dovadă a prezenței ionilor Cl - în analit. Reacțiile descrise au loc conform următoarelor ecuații:
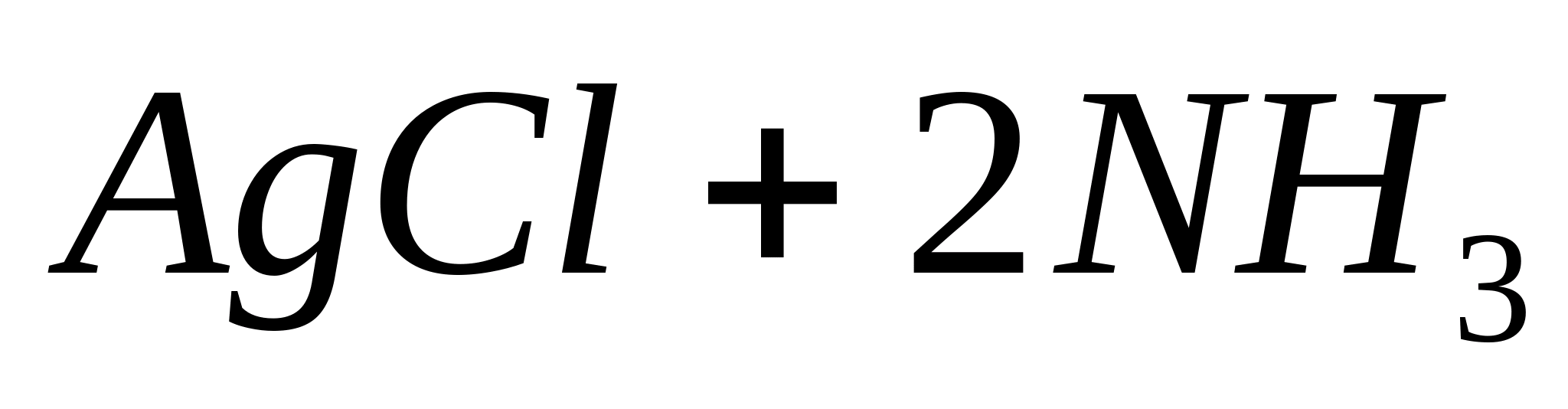
Reacția de oxidare
 -ionii pentru a elibera clorul
-ionii pentru a elibera clorul
Puneți 5 picături dintr-o soluție care conține ioni β într-o eprubetă, adăugați 0,5 ml
soluție concentrată 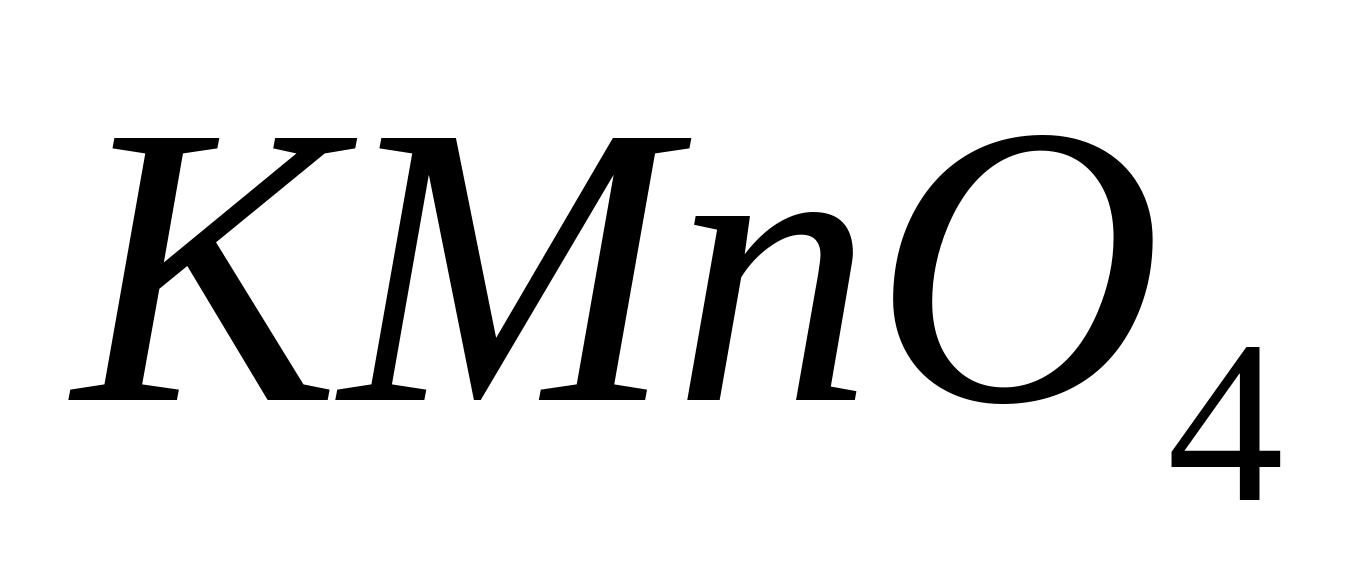 .5 picaturi de concentrat si caldura (sub tractiune!). În acest caz, există o decolorare parțială sau completă a soluției și eliberarea de clor gazos, care este deschis cu hârtie amidon iod (colorare albastră).
.5 picaturi de concentrat si caldura (sub tractiune!). În acest caz, există o decolorare parțială sau completă a soluției și eliberarea de clor gazos, care este deschis cu hârtie amidon iod (colorare albastră).
Reacția se desfășoară conform ecuației:

Pentru a detecta evoluția C1 2, aduceți o umezeală
hârtie amidon iod. În prezența clorului, apare o culoare albastră datorită eliberării de iod elementar:
Au efect oxidant manganiții, manganații, permanganații, manganul și dioxidul de plumb, anhidrida cromică, acizii hipocloros, cloric și azotic etc.
Condiții pentru efectuarea reacțiilor.

sau sub formă ionică:

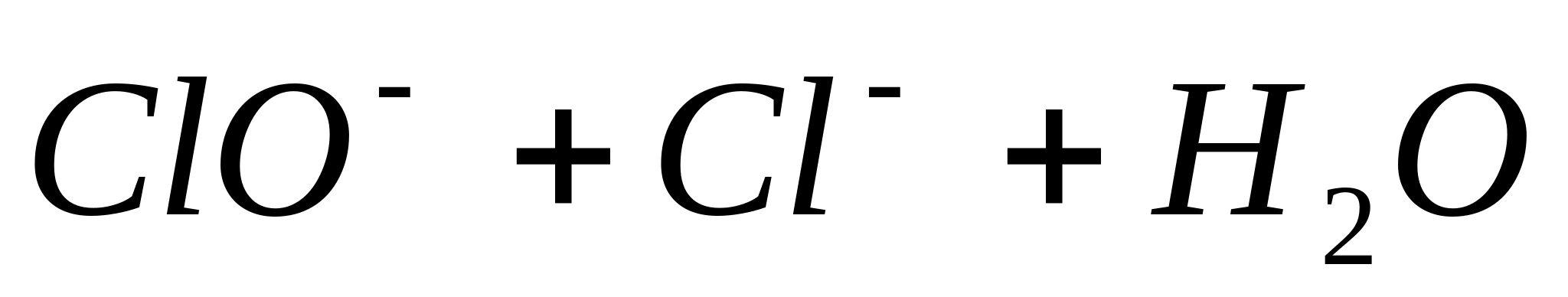
Br -
Reacția cu nitrat de argint
Adăugați câteva picături de acid azotic și soluție la 1-2 ml de soluție de bromură de sodiu sau de potasiu. In prezenta 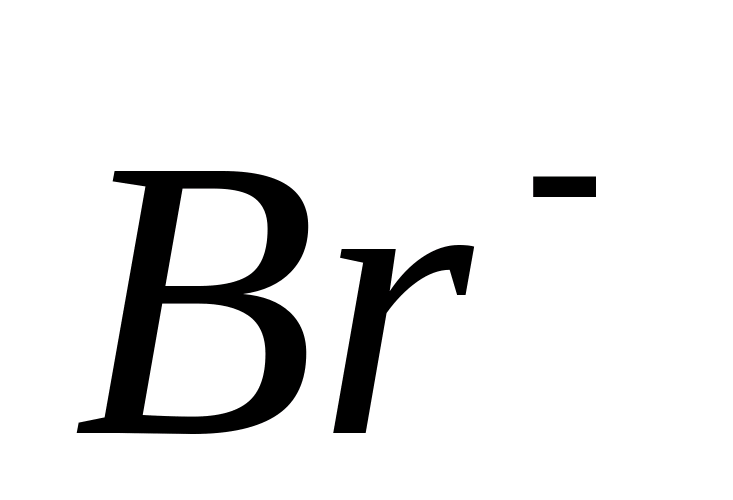 -ionii cade un precipitat coagulat gălbui AgBr... Verificați solubilitatea acestuia în soluție de tiosulfat de sodiu
-ionii cade un precipitat coagulat gălbui AgBr... Verificați solubilitatea acestuia în soluție de tiosulfat de sodiu 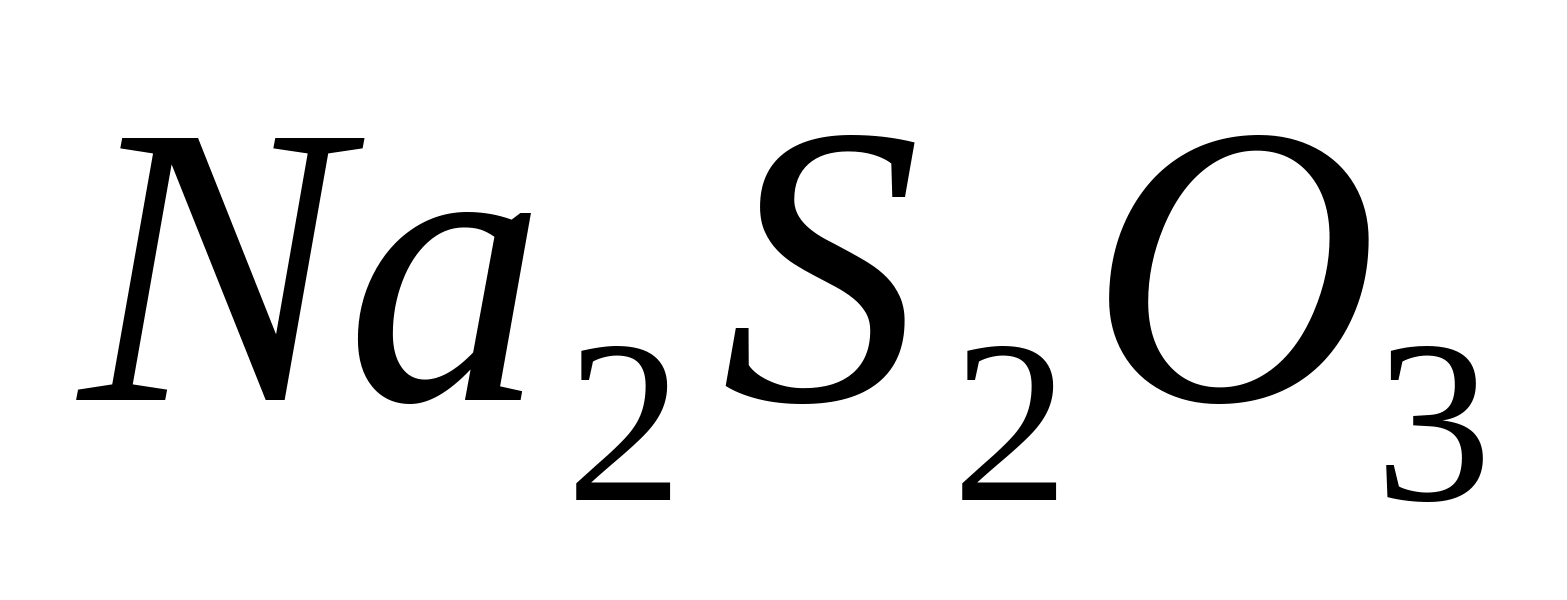 , în soluție de amoniac și în soluție de carbonat de amoniu
, în soluție de amoniac și în soluție de carbonat de amoniu 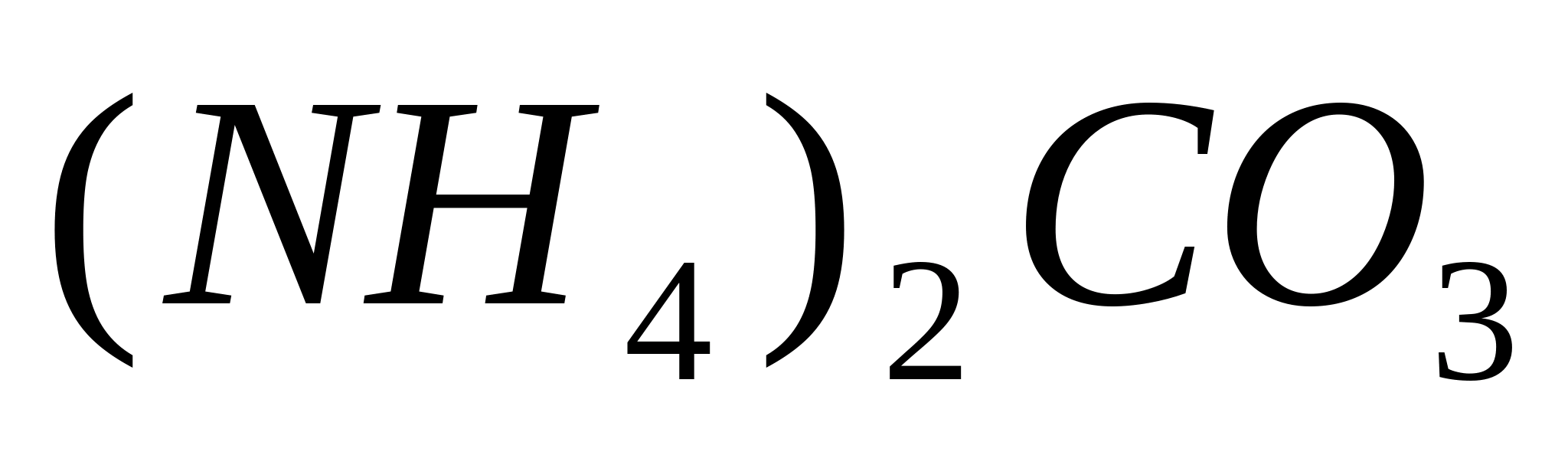 .
.
Reacția de oxidare -ioni apa cu clor pentru a elibera brom
Se pun într-o eprubetă 5 picături de soluție de KBr, 1-2 picături de soluție diluată,
0,5 ml de benzen și 2-3 picături de apă cu clor. Agitați tubul. În prezența ionilor β, benzenul devine galben-maro.
Reacția este aplicabilă pentru detectarea ionilor -în prezența lui - și 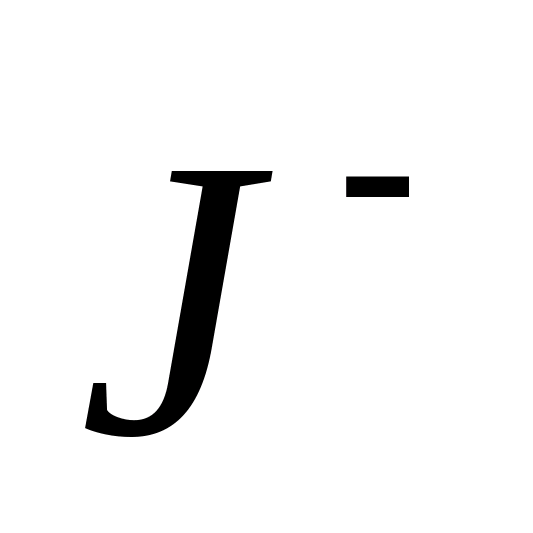 -ioni.
-ioni.
Condiții de reacție.

J -
Reacția cu nitrat de argint.
Ionii (spre deosebire de și -ionii) cu ionii de argint formează un precipitat galben brânză, solubil numai în soluții de cianura de potasiu și.
Adăugați câteva picături de acid azotic și soluție la 1-2 ml de soluție de iodură de sodiu sau de potasiu. Verificați solubilitatea precipitatului rezultat în soluție.
Reacția de oxidare - ionii cu apa clorata pentru a elibera iodul
Reacția se desfășoară în mod similar cu reacția de oxidare a bromurilor cu apă cu clor. Se pun într-o eprubetă 5 picături de soluție de iodură de potasiu KJ, 1-2 picături de acid sulfuric diluat, 0,5 ml
benzen și 1-2 picături de apă cu clor. Agitați conținutul tubului. În prezența ionilor β, stratul de benzen devine roșu-violet:
Cu un exces de Cl 2, iodul liber nu este eliberat și stratul de benzen nu este colorat:
Toți agenții de oxidare utilizați pentru oxidarea HCl și HBr pot fi, de asemenea, utilizați ca agenți de oxidare.
Condiții de reacție.
Reacția de oxidare -ioni cu permanganat de potasiu
Se pun într-o eprubetă 3-5 picături din soluția de testare care conține ioni β, se acidifică soluția cu câteva picături din cea diluată și se adaugă 1-2 picături din soluție.
În prezența ionilor -, soluția se decolorează la rece și se eliberează iod. Încălzirea moderată favorizează reacția:
Condiții de reacție.
De îndată ce apare o culoare roșie, adăugarea soluției este oprită și aceasta
excesul se reduce cu 1-2 picături de peroxid de hidrogen. Excesul de peroxid de hidrogen se descompune prin fierberea soluției.
Iodatul poate fi detectat cu ușurință atunci când se adaugă iodură de potasiu la soluția rezultată. În acest caz, iodul este eliberat într-o cantitate mai mare decât în timpul oxidării direct cu permanganat:
N0 3 -
Reacția de reducere a nitraților la amoniac cu zinc sau aluminiu
Puneți 5 picături de soluție de azotat de potasiu sau de sodiu într-o eprubetă, adăugați 0,5 ml de soluție de NaOH sau KOH și apoi adăugați 25-50 mg de praf de zinc sau pulbere de aluminiu. Pentru a accelera reacția, încălziți amestecul pe un arzător cu gaz.
Praful de zinc (sau pulberea de aluminiu) în soluții alcaline reduce nitrații la amoniac:
Amoniacul eliberat în acest proces este detectat așa cum s-a descris anterior.
Interacțiunea cu difenilamina
Pune 3 picături de soluție de difenilamină pe o lamă de sticlă  în acid sulfuric și 2 picături de soluție de azotat de sodiu. In prezenta
în acid sulfuric și 2 picături de soluție de azotat de sodiu. In prezenta 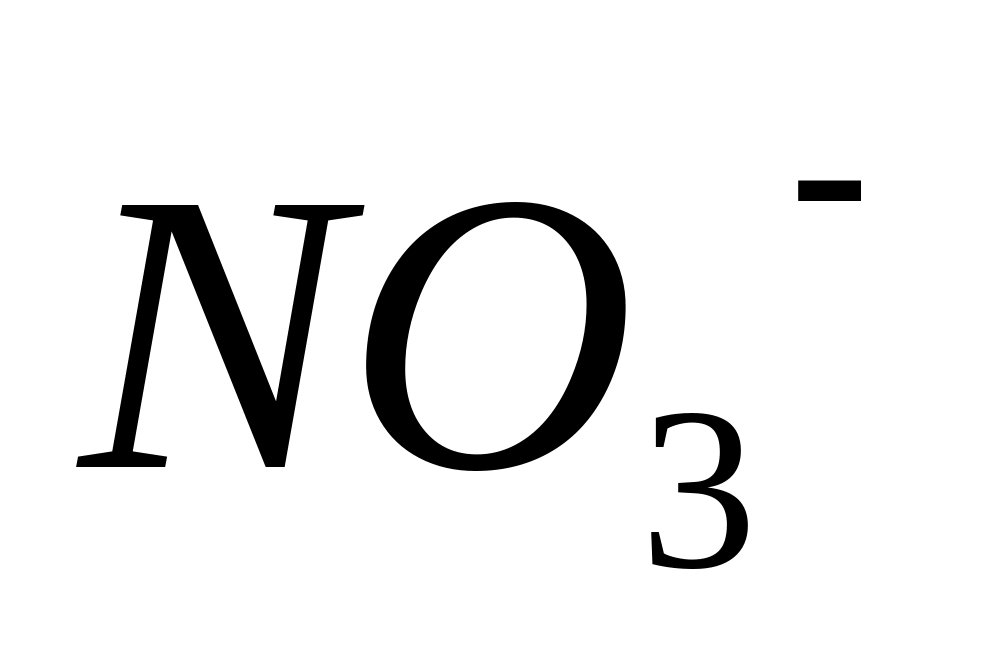 -ioni apar colorare albastru închis cauzate de produșii oxidării difenilaminei cu acid azotic.
-ioni apar colorare albastru închis cauzate de produșii oxidării difenilaminei cu acid azotic.
SO 3 -
Reacția de reducere a acidului sulfuros
Puneți 3-5 picături de soluție de sare într-o eprubetă acid sulfuros(de exemplu, 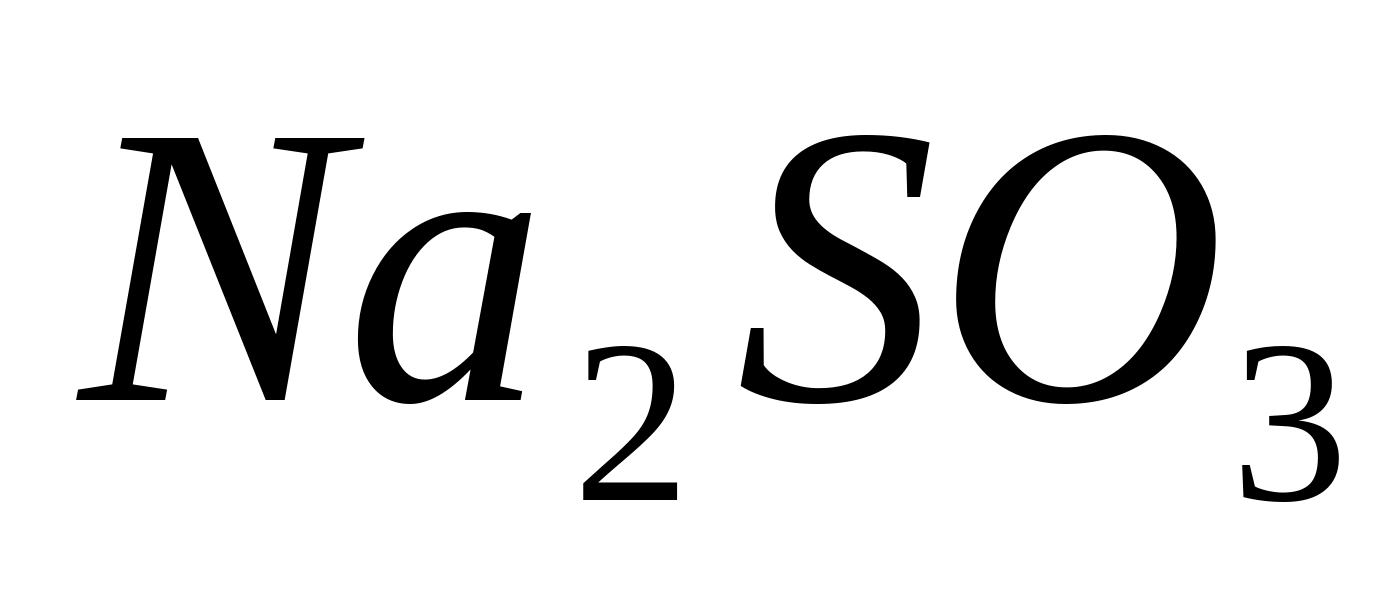 ), 3-5 picaturi de solutie clorhidrica concentrata proaspat preparata
), 3-5 picaturi de solutie clorhidrica concentrata proaspat preparata  și încălziți conținutul tubului. în care
și încălziți conținutul tubului. în care
Pune 1 picătură de soluție pe o bucată de hârtie de filtru  și 1 picătură de rodizonat de sodiu sau soluție de acid rodizonic. În acest caz, se formează o pată roșie de rodizonat de bariu. Umeziți pata roșie cu 1-2 picături de soluție de sulfat de sodiu. În prezența sulfaților, culoarea rodizonatului de bariu dispare imediat. Ionii de bariu cu rodizonat de sodiu sau acid rodizonic dau un precipitat roșu-brun care nu se descompune cu HC1 diluat. Rodizonatul de bariu se decolorează instantaneu cu sulfați și acid sulfuric datorită formării sulfatului de bariu insolubil. Reacția considerată este specifică și este utilizată numai pentru detectarea sulfaților.
și 1 picătură de rodizonat de sodiu sau soluție de acid rodizonic. În acest caz, se formează o pată roșie de rodizonat de bariu. Umeziți pata roșie cu 1-2 picături de soluție de sulfat de sodiu. În prezența sulfaților, culoarea rodizonatului de bariu dispare imediat. Ionii de bariu cu rodizonat de sodiu sau acid rodizonic dau un precipitat roșu-brun care nu se descompune cu HC1 diluat. Rodizonatul de bariu se decolorează instantaneu cu sulfați și acid sulfuric datorită formării sulfatului de bariu insolubil. Reacția considerată este specifică și este utilizată numai pentru detectarea sulfaților.
CO 3 -
R  reacția de formare a dioxidului de carbon (dioxid de carbon)
reacția de formare a dioxidului de carbon (dioxid de carbon)
Se introduce 1 ml de soluție de carbonat de sodiu Na 2 CO 3 într-o eprubetă, se adaugă soluție 2 M HC1 în ea și se închide rapid eprubeta cu un dop, în care se introduce un tub ramificat. Înmuiați celălalt capăt al acestui tub într-o eprubetă cu apă de var (fig.).
Dioxidul de carbon care trece printr-o soluție de Ca (OH) 2 formează un precipitat alb sau ceață de CaCO 3.
Scrieți ecuația reacției în forme moleculare și ionice.
RO 4 ---
Reacția cu molibdat de amoniu
Se toarnă 1 ml de soluție de fosfat de sodiu într-o eprubetă 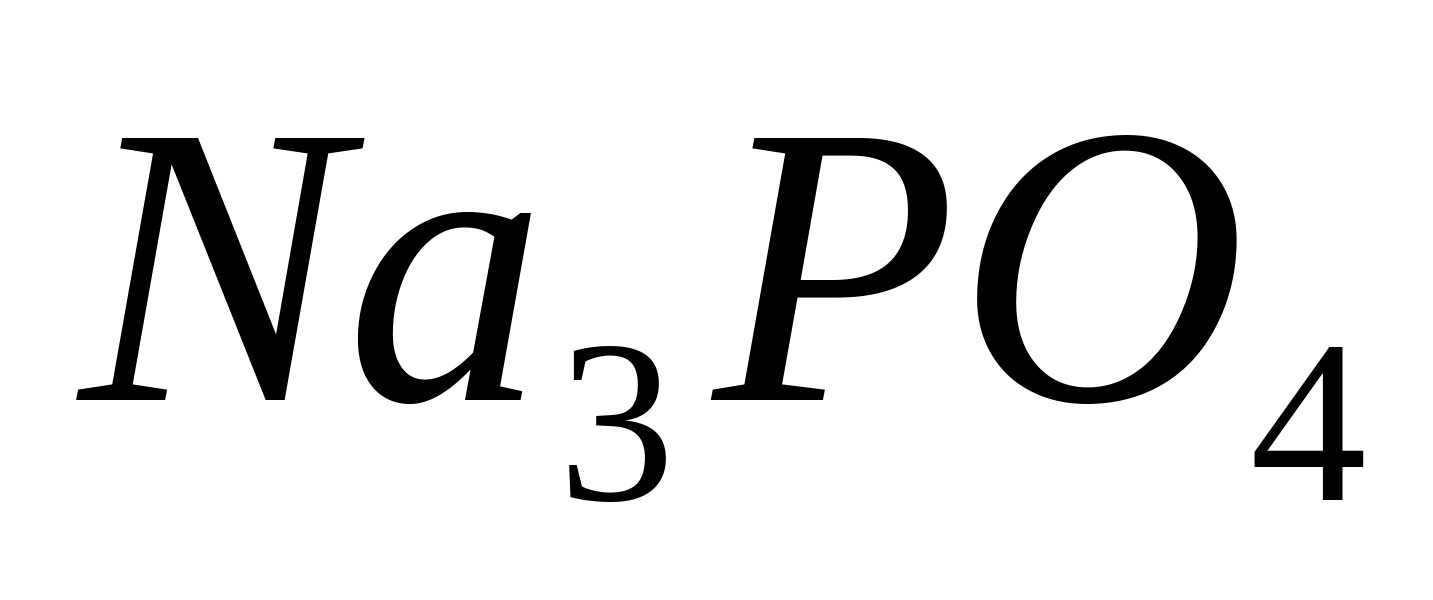 sau potasiu, se adaugă câteva picături de 6M HNO 3 și puțină sare solidă - molibdat de amoniu (NH 4) 2 MoO 4. Încălziți conținutul tubului. Apare un precipitat galben de fosforomolibdat de amoniu.
sau potasiu, se adaugă câteva picături de 6M HNO 3 și puțină sare solidă - molibdat de amoniu (NH 4) 2 MoO 4. Încălziți conținutul tubului. Apare un precipitat galben de fosforomolibdat de amoniu.
PO 4 3- + 3NH 4 + + 12 MoO 4 2- + 24 ore + = (NH 4 ) 3 PO 4 ∙ 12 MoO 3 ∙ 2H 2 O ↓ + 10 H 2 O
Precipitatul se dizolvă ușor într-o soluție apoasă de amoniac.
Sarcina de control.
Se dă sare. Determinați ce cation și anion sunt incluse în compoziția sa.
Analiza sării
1. Teste preliminare
a) Colorarea la flacără.
Na + - galben
Ca 2+ - roșu cărămidă
K + - violet
Ba 2+ - galben-verde
Cu 2+ - verde.
c) Verificarea pH-ului soluţiilor apoase.
Dacă pH-ul > 7, atunci sarea conține un cation de bază puternic (metal alcalin sau alcalino-pământos)
Dacă pH-ul este 7, atunci este o sare formată dintr-o bază tare și un acid tare.
G) Acțiunea acidului sulfuric diluat – numai ioni de carbonat CO 3 2 – se descompune cu acizi diluați cu eliberare de CO2.
e) Acţiunea acidului sulfuric concentrat - descompune Cl -, Br -, J -, NO 3 -, MnO 4 - cu eliberare de Cl 2, HCl, HBr, Br 2, J 2, NO 2, O 2 etc.
f) Detectarea unor cationi.
NH 4 +
Adăugați soluția de reactiv Nessler la picătura de probă. Apariția unui precipitat roșu-brun dovedește prezența unui ion de amoniu în sare.
Se adaugă soluție de hidroxid de sodiu la probă și se încălzește. În prezența unui ion de amoniu în sare, apare mirosul de amoniac, iar pe un baston umezit cu o soluție de acid clorhidric concentrat - un strat alb de clorură de amoniu.
Fe 3+
Se adaugă soluție de K4 la probă. Se formează albastrul prusac.
Adăugați câteva picături de KSNS la probă. Apare o culoare roșie.
Fe 2+ Se adaugă soluție de K3 la probă. Se remarcă aspectul turnbull albastru.
2. Progresul analizei .
1. În primul rând, cationii sunt determinați în probă.
2. La a doua etapă de analiză se determină anioni în probă. Înainte de aceasta, se efectuează teste preliminare pentru conținutul de ioni Cl -, SO 4 -2. Pentru aceasta, soluțiile de AgNO3 și Ba (NO3)2 sunt turnate în porțiuni separate de probă. Precipitarea unui precipitat coagulat de Ag Cl și Ba SO4 cristalin indică prezența acestor ioni în probă.
DocumentLucrarea de examinare numărul 1 Calitate analiză... Echilibre eterogene PROBA DE SOLUȚIE Calitate analiză Grup și calitate reacții la cationiși anionii necesari...
Analiza hormonilor, antigenelor, anticorpilor și vitaminelor (2)
AnalizăTenge 590 tenge 179. Eozinofil cationic proteine (ECP) 5 w.d. - ... w.d.-1500 tenge 52. Virusul hepatitei B ( calitate analiză) / Real-time / (sensibilitate 5 UI ... 3-5 w.d.-5000 tenge 54. Virusul hepatitei D ( calitate analiză) / În timp real / sânge cu EDTA 1-2 ...
Programul de lucru al disciplinei „chimie analitică” Profesia: „Asistent de laborator-ecologist”
Program de lucruPentru colorarea complexelor. 1h TEMA: Calitate analiză cationiși anioni 1. Interacțiunea ionilor de bariu ... (1). Subiectul 6 Calitate analiză cationiși anioni. Clasificarea hidrogenului sulfurat cationi... Primul grup analitic cationi (cationi grupe de sodiu...
Dyldina Julia
Flacăra poate avea o culoare diferită, totul depinde doar de sarea metalică care i se adaugă.
Descarca:
Previzualizare:
MAOU SOSH № 40
Temă
Colorarea cu flacără ca una dintre metodele chimiei analitice.
Dyldin Yudiya,
clasa 9g, MAOU SOSH nr. 40
supraveghetor:
Gurkina Svetlana Mihailovna,
Profesor de biologie și chimie.
Perm, 2015
- Introducere.
- Capitolul 1 Chimie analitică.
- Capitolul 2 Metode de chimie analitică.
- Capitolul 3 Reacții de colorare a flăcării.
- Concluzie.
Introducere.
Încă din copilărie am fost fascinat de munca chimiștilor. Păreau a fi magicieni care, după ce au învățat niște legi ascunse ale naturii, au făcut necunoscutul. În mâinile acestor vrăjitori, substanțele și-au schimbat culoarea, s-au aprins, s-au încălzit sau s-au răcit, au explodat. Când am venit la lecțiile de chimie, cortina a început să se ridice și am început să înțeleg cum au loc procesele chimice. Cursul de chimie pe care l-am urmat nu mi-a fost suficient, așa că am decis să lucrez la proiect. Mi-am dorit ca subiectul la care lucrez să aibă sens, să mă ajute să mă pregătesc mai bine pentru examenul de chimie și să-mi satisfacă pofta de reacții frumoase și vii.
Studiem colorarea unei flăcări cu ioni de metal în diferite culori chiar și la lecțiile de chimie, când trecem prin metale alcaline. Când am devenit interesat de acest subiect, s-a dovedit că, în acest caz, nu a fost dezvăluit pe deplin. Am decis să-l studiez mai detaliat.
Ţintă: Cu ajutorul acestei lucrări vreau să învăț cum să determin compoziția calitativă a unor săruri.
Sarcini:
- Familiarizați-vă cu chimia analitică.
- Studiați metodele de chimie analitică și alegeți cele mai potrivite pentru munca mea.
- Cu ajutorul unui experiment, determinați ce metal face parte din sare.
Capitolul 1.
Chimie analitică.
Chimie analitică -o ramură a chimiei care studiază compoziția chimică și parțial structura substanțelor.
Scopul acestei științe este de a determina elementele chimice sau grupele de elemente care alcătuiesc compoziția substanțelor.
Subiectul studiului ei este îmbunătățirea metodelor existente și dezvoltarea de noi metode de analiză, căutarea oportunităților pentru aplicarea lor practică, cercetarea fundamente teoretice metode de analiză.
În funcție de sarcina metodelor, se face distincția între analiza calitativă și cea cantitativă.
- Analiza calitativă - un set de metode chimice, fizico-chimice și fizice utilizate pentru a detecta elementele, radicalii și compușii care formează un analit sau un amestec de substanțe. Într-o analiză calitativă se pot folosi reacții chimice caracteristice, ușor de executat, în care se poate observa apariția sau dispariția culorii, precipitarea sau dizolvarea unui precipitat, formarea de gaz etc.. Astfel de reacții se numesc calitative și cu ajutorul ei se poate verifica cu ușurință compoziția unei substanțe.
Analiza calitativă se realizează cel mai adesea în soluții apoase. Se bazează pe reacții ionice și vă permite să detectați cationii sau anionii substanțelor care sunt conținute acolo. Robert Boyle este considerat a fi fondatorul acestei analize. El a introdus acest concept de elemente chimice ca despre părțile de bază nedescompuse ale substanțelor complexe, după care a sistematizat toate reacțiile calitative cunoscute la vremea lui.
- Analiza cantitativă - un set de metode chimice, fizico-chimice și fizice pentru determinarea raportului dintre componentele care compun
analit. Din rezultatele acesteia, este posibil să se determine constantele de echilibru, produșii de solubilitate, masele moleculare și atomice. O astfel de analiză este mai dificil de realizat, deoarece necesită o abordare precisă și mai minuțioasă, altfel rezultatele pot da erori mari și munca va fi redusă la zero.
Analiza cantitativă este de obicei precedată de analiză calitativă.
Capitolul 2.
Metode de analiză chimică.
Metodele de analiză chimică sunt împărțite în 3 grupe.
- Metode chimicebazat pe reacții chimice.
În acest caz, numai acele reacții pot fi folosite pentru analiză care sunt însoțite de un efect extern vizual, de exemplu, o schimbare a culorii soluției, eliberarea de gaze, precipitarea sau dizolvarea precipitatelor etc. Aceste efecte externe vor servesc drept semnale analitice în acest caz. Modificările chimice care au loc se numesc reacții analitice, iar substanțele care provoacă aceste reacții se numesc reactivi chimici.
Toate metodele chimice sunt împărțite în două grupuri:
- Reacția se realizează în soluție în așa-numitul „mod umed”.
- Metoda de realizare a analizei cu solide fără utilizarea solvenților, această metodă se numește „cale uscată”. Este împărțit în analiză pirochimică și analiză de frecare. Laanaliza pirochimică şiSubstanța de testat este încălzită într-o flacără a unui arzător cu gaz. În acest caz, sărurile volatile (cloruri, nitrați, carbonați) ale unui număr de metale conferă o anumită culoare flăcării. O alta metoda de analiza pirotehnica este obtinerea de perle colorate (ochelari). Pentru obținerea perlelor, sărurile și oxizii metalici se topesc cu tetraborat de sodiu (Na2 B4O7 „10H2O) sau fosfat acid de amoniu și sodiu (NaNH4HP04 4H20) și se observă culoarea paharelor (perle) rezultate.
- Metoda de frecare a fost propus în 1898 F.M. Flavitsky. Substanța solidă de testat se triturează cu un reactiv solid, în timp ce se observă efect extern... De exemplu, sărurile de cobalt cu tiocianat de amoniu pot da o colorare albastră.
- Când sunt analizate prin metode fizicestudiu proprietăți fizice substanțe folosind instrumente, fără a recurge la reacții chimice. Metodele fizice includ analiza spectrală, luminiscent, structural cu raze X și alte metode de analiză.
- Folosind metode fizice și chimicestudiu fenomene fizice care au loc în reacții chimice. De exemplu, în metoda colorimetrică se măsoară intensitatea culorii în funcție de concentrația substanței; în analiza conductometrică se măsoară modificarea conductivității electrice a soluțiilor.
Capitolul 3.
Lucrări de laborator.
Reacții de colorare a flăcării.
Ţintă: Pentru a studia colorarea flăcării unei lămpi cu alcool cu ioni metalici.
În munca mea, am decis să folosesc metoda de analiză pirotehnică a colorării în flacără cu ioni metalici.
Substante de testare:săruri metalice (fluorura de sodiu, clorură de litiu, sulfat de cupru, clorură de bariu, clorură de calciu, sulfat de stronțiu, clorură de magneziu, sulfat de plumb).
Echipament: pahare de portelan, alcool etilic, bagheta de sticla, acid clorhidric concentrat.
Pentru a efectua lucrarea, am făcut o soluție de sare în alcool etilic, apoi am dat foc. Mi-am petrecut experiența de mai multe ori, la ultima etapă au fost selectați cele mai bune mostre, domeniul căruia am realizat un videoclip.
Concluzii:
Sărurile volatile ale multor metale colorează flacăra într-o varietate de culori care sunt caracteristice acestor metale. Culoarea depinde de vaporii incandescenți ai metalelor libere, care se obțin ca urmare a descompunerii termice a sărurilor atunci când acestea sunt introduse în flacăra arzătorului. În cazul meu, astfel de săruri au fost fluorură de sodiu și clorură de litiu, au dat culori strălucitoare saturate.
Concluzie.
Analiza chimică este folosită de oameni în foarte multe domenii, în timp ce la lecțiile de chimie ne familiarizăm doar cu o mică zonă a acestei științe complexe. Tehnicile care sunt utilizate în analiza pirochimică sunt utilizate în analiza calitativă ca test preliminar în analiza unui amestec de solide sau ca reacții de verificare. În analiza calitativă, reacțiile „uscate” joacă doar un rol auxiliar, ele fiind de obicei folosite ca teste primare și reacții de verificare.
În plus, aceste reacții sunt folosite de oameni în alte industrii, de exemplu, în artificii. După cum știm, artificiile sunt lumini decorative de diverse culori și forme, obținute prin arderea compozițiilor pirotehnice. Deci, la compoziția artificiilor de pirotehnică se adaugă diverse substanțe combustibile, printre care elementele nemetalice (siliciu, bor, sulf) sunt larg reprezentate. În procesul de oxidare a borului și a siliciului, se eliberează o cantitate mare de energie, dar nu se formează produse gazoase, prin urmare, aceste substanțe sunt folosite pentru a face fuzibile cu acțiune întârziată (pentru a aprinde alți compuși la un anumit moment). Multe amestecuri includ materiale organice carbonice. De exemplu, cărbune(utilizat în pulbere neagră, proiectile de artificii) sau zahăr (grenade fumigene). Se folosesc metale active din punct de vedere chimic (aluminiu, titan, magneziu), a căror ardere la temperaturi ridicate dă lumină puternică... Au început să folosească această proprietate pentru a lansa focuri de artificii.
În procesul de lucru, mi-am dat seama cât de dificil și important este să lucrezi cu substanțe, nu totul a avut succes pe deplin, așa cum mi-aș dori. De regulă, la lecțiile de chimie nu există suficientă practică, datorită căreia se exersează abilitățile teoretice. Proiectul m-a ajutat să dezvolt această abilitate. În plus, cu mare plăcere le-am prezentat colegilor de clasă rezultatele muncii mele. Acest lucru i-a ajutat să-și consolideze cunoștințele teoretice.

 Care ar trebui să fie iubitul tău?
Care ar trebui să fie iubitul tău? Ce fel de tip ar trebui să fie?
Ce fel de tip ar trebui să fie? Ce poți oferi unei fete pentru noul an?
Ce poți oferi unei fete pentru noul an? Cele mai bune gânduri din toate timpurile Cele mai bune gânduri din toate timpurile sunt în contact
Cele mai bune gânduri din toate timpurile Cele mai bune gânduri din toate timpurile sunt în contact